Профилактика
Часть I. Исследование крови
Глава 1. Общеклиническое исследование крови
Кровь – один из видов соединительной ткани. Благодаря своему жидкому состоянию она имеет возможность циркулировать по всему организму и снабжать остальные ткани кислородом и питательными веществами, в то же время удаляя из организма углекислый газ и продукты распада. Общее количество крови у взрослых женщин – около 4–5 л, а у мужчин – 5–6 л. Кровь состоит из собственно жидкой части – плазмы – и так называемых форменных (или клеточных) элементов: красных кровяных телец (эритроцитов), белых кровяных телец (лейкоцитов) и кровяных пластинок (тромбоцитов).
Такие показатели, как содержание гемоглобина в эритроцитах, скорость оседания эритроцитов, соотношение объема жидкой и клеточной частей крови, количество и состав форменных элементов (так называемая лейкоцитарная формула), – являются основными подсказками, по которым врач сможет судить о состоянии вашего организма.
Для правильной оценки полученных результатов врач должен сравнить их с показателями нормы – характеристиками крови здорового человека. Изменения, связанные с увеличением процентного содержания той или иной формы клеток в периферической крови, свидетельствуют о состояниях, название которых образуется при помощи окончания «-ия», «-оз» или «-ез», добавленного к названию соответствующего вида клеток (нейтрофилез, эозинофилия, эритроцитоз и т. д.). Снижение процентного содержания отдельных форм клеток выражается в прибавлении к их названиям окончания «-пения» (нейтропения, эозинопения и т. д.).
Взятие крови
Если вы получили направление на анализ крови, необходимо соблюсти некоторые правила, чтобы результаты анализа были наиболее точными. Кровь из пальца сдается утром и натощак. Это значит, что после последнего приема пищи должно пройти 8–12 часов. Исключение составляют лишь экстренные случаи, когда врач подозревает развитие серьезных острых заболеваний (острый аппендицит, инфаркт миокарда и т. д.).
Перед сдачей анализа возможно употребление небольшого количества питьевой воды (но не сладкого чая!). В случае употребления алкоголя лучше вообще переждать 2–3 дня. Кроме того, не следует перед посещением лаборатории подвергать свой организм каким-либо интенсивным воздействиям (это может быть что угодно: атлетический кросс, поднятие тяжестей или даже посещение парной или сауны).
В лаборатории исследуют либо капиллярную кровь, которую получают из безымянного пальца руки или мочки уха, либо венозную кровь из локтевой вены. Перед взятием крови место прокола протирают сперва 70%-ным раствором спирта, а потом эфиром. Укол пальца лучше производить сбоку, где наиболее густая сеть капилляров. Кровь должна вытекать свободно, не следует перед уколом разминать палец или выдавливать кровь, чтобы не происходило ее перемешивание с тканевой жидкостью. Первую каплю крови удаляют ватным тампоном, а следующие используют для анализов.
Гемоглобин
Гемоглобин (Hb) составляет 95% от белков эритроцита. Отсутствие ядра в эритроците предоставляет место для большего количества молекул гемоглобина. Это означает, что клетка может нести больше кислорода. Дело в том, что кислород очень плохо растворяется в плазме крови, зато охотно вступает в соединение с гемоглобином. Железо в гемоглобине заставляет клетки становиться красными в присутствии кислорода (подобно тому, как железо становится красным, когда ржавеет). Молекула гемоглобина состоит из меньшей небелковой части (то есть гема), содержащей железо, и белка – глобина.
Концентрация гемоглобина в крови в основном зависит от пола: у взрослых мужчин в норме она составляет 130—160 г/л, а у женщин – 120—140 г/л.
Повышение концентрации гемоглобина отмечается при:
- первичной и вторичной эритремии (повышенном числе эритроцитов);
- обезвоживании (сгущении крови).
Понижение концентрации гемоглобина отмечается при:
- гипергидратации (разжижении крови);
- анемии.
При анемии снижается количество кислорода, доставляемое жизненно важным органам, и поэтому падение концентрации гемоглобина ниже 60 г/л считается опасным для жизни и требует экстренного переливания крови или эритроцитарной массы.
Эритроциты
По сути своей эритроциты являются мешками с гемоглобином, белком, несущим кислород. Без ядра эритроциты неспособны к делению, так что они представляют «клетки-самоубийцы», работающие до тех пор, пока они не будут разрушены клетками-фагоцитами или селезенкой. Форма эритроцита немного необычна; она напоминает двояковогнутый диск. Представьте себе бублик или пончик, где вместо отверстия центр просто зажимается. Такая форма создает оптимальное соотношение поверхности клетки к ее объему: двояковогнутые эритроциты получают возможность максимально насыщаться кислородом или углекислым газом – в зависимости от того, какую задачу выполняет клетка в данный момент. В норме у взрослого мужчины в крови эритроцитов должно быть 4,0–5,0 1012/л, а у женщины – 3,7–4,7 1012/л.
Увеличение количества эритроцитов и гематокрита (см. ниже) говорит об эритроцитозе. Он бывает первичным (при первичной эритроцитемии) или вторичным (как правило, это результат кислородного голодания тканей). Резко выраженная первичная эритроцитемия (8,0–12,0 1012/л и более) почти всегда сопутствует одной из форм лейкоза – эритремии.
Вторичное увеличение количества эритроцитов наблюдается при:
- легочных заболеваниях;
- врожденных пороках сердца;
- пребывании на высоте;
- молекулярных изменениях гемоглобина (в частности, накоплении карбоксигемоглобина).
Уменьшение содержания эритроцитов в крови – а низкий уровень гемоглобина прежде всего сигнализирует именно о нем – наблюдается при:
- кровопотере (при этом строение самих клеток остается нормальным);
- анемии;
- беременности (в последних триместрах);
- снижении скорости размножения эритроцитов в костном мозге;
- ускоренном разрушении эритроцитов;
- гипергидратации.
Для постановки диагноза важно также учитывать размеры и форму эритроцитов. Анизоцитоз – или наличие в крови эритроцитов различной величины – чаще всего наблюдается при анемиях. У здорового человека эритроциты имеют диаметр примерно 7,5 мкм и называются нормоцитами. Соответственно уменьшенные эритроциты называются микроцитами, а увеличенные – макроцитами.
Микроцитоз наблюдается при:
- гемолитической анемии;
- анемии после хронической кровопотери;
- злокачественных заболеваниях.
Макроцитоз наблюдается при:
- В12– и фолиеводефицитной анемиях;
- малярии;
- заболеваниях печени;
- заболеваниях легких.
Специфические изменения формы эритроцитов могут быть признаками ряда врожденных заболеваний. Например, при талассемии (а также при отравлении свинцом) в крови появляются мишенеподобные клетки (т. е. эритроциты с окрашенным участком в центре). А при серповидноклеточной анемии эритроциты принимают характерную форму серпа.
Периферическая кровь может содержать молодые формы эритроцитов: их называют ретикулоцитами. В норме их должно быть 0,2–1,2% от общего количества эритроцитов. Этот показатель иллюстрирует интенсивность работы костного мозга, вырабатывающего новые эритроциты. Если пациент лечится от анемии, вызванной дефицитом витамина В12, то ретикулоцитоз (увеличение доли ретикулоцитов по отношению к общему числу эритроцитов в периферической крови) можно считать хорошим признаком. В ходе лечения врач наблюдает такое явление, как ретикулоцитарный криз, то есть точку накопления в крови максимального количества ретикулоцитов.
В свою очередь, низкий уровень ретикулоцитов, сопровождающий затяжную анемию, сигнализирует о низкой активности костного мозга, и врачи относят его к неблагоприятным признакам.
Цветовой показатель
Цветовой показатель (ЦП) – это величина, отражающая содержание гемоглобина в эритроцитах по отношению к норме. В норме он составляет 0,9–1,1.
Снижение ЦП (гипохромия) меньше 0,8 указывает на:
- железодефицитную анемию;
- анемию при отравлении свинцом;
- анемию при беременности.
Повышение ЦП (гиперхромия) больше 1,1 указывает на:
- дефицит витамина В12;
- дефицит фолиевой кислоты;
- рак;
- полипоз желудка.
Если уровень эритроцитов и гемоглобина низок, а ЦП остается в пределах нормы, врачи говорят о нормохромной анемии, в том числе о гемолитической анемии (когда происходит ненормально быстрое разрушение эритроцитов) и об апластической анемии (когда костный мозг производит слишком мало эритроцитов).
Гематокрит
Гематокрит, или гематокритное число – это отношение объема эритроцитов к объему плазмы. Он является еще одним признаком избытка или недостатка в крови красных кровяных телец.
У здоровых мужчин он составляет 0,40–0,52 л/л, у женщин – 0,36–0,42 л/л, у новорожденных – 0,54–0,68 л/л.
Повышение гематокрита бывает связано либо с гиперпродукцией эритроцитов, либо с увеличением их размеров (см. выше).
Понижение гематокрита наблюдается при:
- потере крови (острых кровотечениях);
- снижении темпа образования эритроцитов в костном мозге;
- ускоренном разрушении эритроцитов;
- увеличении объема крови (например, при внутривенном введении жидкостей);
- анемии;
- беременности;
- гиперпротеинемии (см. ниже);
- гипергидратации (разжижении крови).
Скорость оседания эритроцитов (СОЭ)
По всей видимости, СОЭ, или скорость оседания эритроцитов, может считаться показателем, лучше всего известным широкой публике. Точно так же, как тот факт, что повышение СОЭ является неблагоприятным признаком.
Скорость оседания эритроцитов демонстрирует скорость разделения столбика несвернувшейся крови, помещенной в специальный стеклянный капилляр, на нижний слой осевших эритроцитов и верхний слой прозрачной плазмы. Число на делении капилляра, соответствующее границе между плазмой и эритроцитами, и будет скоростью оседания эритроцитов в миллиметрах в час.
В норме СОЭ здорового человека определяется в основном его полом и может находиться в пределах 1–10 мм/час у мужчин и 2–15 мм/час у женщин. Кроме того, на СОЭ может повлиять ряд физиологических состояний (например, прием пищи – до 25 мм/час, менструация или беременность – до 45 мм/час), связанных с возрастанием в плазме крови соотношения крупных белковых частиц (глобулинов) и мелких (альбуминов).
Глобулинами являются и защитные антитела, выбрасываемые в периферическую кровь для борьбы с воспалительными агентами (вирусами, бактериями, грибками и т. п.). Повышенное содержание в плазме глобулинов повышает и СОЭ, вот почему его возрастание действительно является тревожным признаком, увеличивающимся тем значительнее, чем активнее идет воспалительный процесс. СОЭ может подниматься до 15—20 мм/час при легких формах воспаления и достигать 60—80 мм/час при ряде тяжелых заболеваний. Зато по уменьшению СОЭ врач может судить о том, насколько успешно назначенное им лечение. Повышение СОЭ вызывают следующие состояния, связанные с воспалительными реакциями:
- инфекционно-воспалительные заболевания (острые и хронические инфекции, пневмония, ревматизм, инфаркт миокарда, сифилис, туберкулез, сепсис);
- коллагенозы (ревматизм, ревматоидный полиартрит);
- травмы, переломы костей;
- оперативные вмешательства.
Однако следует помнить, что повышение СОЭ могут вызвать и следующие невоспалительные состояния:
- поражения печени;
- заболевания почек (нефротический синдром);
- эндокринные нарушения (сахарный диабет, тиреотоксикоз);
- заболевания системы крови (анемия, лимфогранулематоз, миеломная болезнь);
- беременность, послеродовой период, менструация;
- отравления химическими веществами (свинец, мышьяк);
- анемии;
- злокачественные гранулемы; моноклональные гаммапатии (миелома, макроглобулинемия Вальденстрема, иммунопролиферативные заболевания);
- влияние препаратов (морфина, декстрана, метилдофа, витамина D).
Снижение СОЭ происходит при:
- эритремии и реактивных эритроцитозах;
- гипербилирубинемии (см. ниже);
- повышении уровня желчных кислот;
- хронической недостаточности кровообращения;
- гипофибриногенемии;
- влиянии препаратов (хлористый кальций, аспирин).
Лейкоциты
Белые кровяные тельца, или лейкоциты, на самом деле являются бесцветными клетками. Они могут иметь округлую или неправильную форму и различные размеры (от 6 до 20 мкм). Кроме того, их характерной особенностью является способность к свободному передвижению, напоминающее самое примитивное одноклеточное существо – амебу. Хотя есть много типов белых кровяных телец, все они выполняют сходные функции защиты от болезнетворных организмов, чужеродных веществ, антигенов и мертвых клеток. У здорового человека в периферической крови лейкоцитов содержится гораздо меньше, чем эритроцитов, – в пределах 4,0–9,0 109/л. Несмотря на схожесть их функций, есть и различия.
Различают два вида лейкоцитов. Первый вид – гранулоциты, чья цитоплазма имеет зернистость. В зависимости от особенностей окраски цитоплазматических зерен гранулоциты делят на базофилы, эозинофилы и нейтрофилы. Среди нейтрофилов в свою очередь различают палочкоядерные и сегментоядерные – в зависимости от формы ядра.
Второй вид лейкоцитов не имеет зерен в цитоплазме, и их делят на лимфоциты (большие и малые) и моноциты.
Благодаря тому, что каждый из перечисленных видов лейкоцитов выполняет вполне определенные задачи, изменение их количества в периферической крови, отражающееся в лейкоцитарной формуле (см. ниже), служит важной подсказкой при постановке диагноза.
Если количество лейкоцитов в крови превышает норму (9,0 109/л), говорят о лейкоцитозе, но при этом следует различать физиологический лейкоцитоз, возникающий у здоровых людей в ответ на вполне рядовые ситуации, и лейкоцитоз патологический, возникающий как следствие болезни.
Физиологический лейкоцитоз наблюдается:
- при беременности (особенно в последних триместрах);
- перед менструацией;
- после родов – в период грудного вскармливания;
- после большой физической нагрузки;
- после горячих или холодных ванн;
- после психоэмоционального напряжения;
- через 2–3 часа после приема пищи (пищеварительный лейкоцитоз).
Именно поэтому выше мы говорили о необходимости сдавать анализы утром натощак в спокойном состоянии и без предварительных экстремальных нагрузок на организм.
Патологический лейкоцитоз развивается чаще всего как следствие:
- острого воспалительного процесса;
- гнойного процесса;
- большинства инфекционных заболеваний: пневмонии, отита, рожистого воспаления, менингита и т. д.;
- относительно обширных ожогов;
- инфаркта сердца, легких, селезенки, почек;
- кровоизлияниях в мозг;
- состояниях после тяжелых кровопотерь;
- диабетической коме;
- хронической почечной недостаточности.
Наиболее остро выраженный лейкоцитоз наблюдается при:
- сепсисе (до 70—80 109/л);
- острых и хронических лейкозах (до 100 109/л).
Если количество лейкоцитов ниже нормы (4 109/л), говорят о лейкопении: чаще всего она является признаком угнетения выработки молодых форм лейкоцитов в костном мозге.
Лейкопения наблюдается при:
- лучевой болезни;
- воздействии ионизирующего излучения;
- приеме ряда лекарственных препаратов: сульфаниламидов и некоторых антибиотиков (хлорамфеникола), антиспазматических пероральных препаратов, тиреостатиков, нестероидных противовоспалительных средств, противоэпилептических препаратов;
- вирусных заболеваниях;
- гипопластических или апластических заболеваниях, когда в костном мозге по неизвестным причинам подавляется выработка отдельных видов клеток крови;
- гиперспленизме (увеличенной функции селезнки);
- системной красной волчанке;
- анемии, связанной с нехваткой витамина В12;
- начальных стадиях развития лейкозов;
- раковых заболеваниях с метастазами в костный мозг.
Лейкоцитарная формула
Лейкоцитарная формула, или лейкограмма, – это соотношение в периферической крови различных форм лейкоцитов, выраженное в процентах. Нормальные показатели лейкограммы приведены в табл. 1.
Таблица 1
Лейкоцитарная формула крови и содержание различных типов лейкоцитов у здоровых людей

Изменения лейкограммы, связанные с увеличением процентного содержания той или иной формы клеток в периферической крови, свидетельствуют о состояниях, название которых образуется при помощи окончания «-ия», «-оз» или «-ез», добавленного к названию соответствующего вида лейкоцитов (нейтрофилез, эозинофилия, моноцитоз и т. д.). Снижение процентного содержания отдельных форм лейкоцитов выражается в прибавлении к их названиям окончания «-пения» (нейтропения, эозинопения и т. д.).
Врач должен различать абсолютное и относительное изменение в содержании разных форм лейкоцитов. Абсолютным считается изменение, когда за пределами нормы находится и их процентное содержание в лейкограмме, и абсолютное содержание в литре крови (число клеток 109/л, с учетом общего количества лейкоцитов у данного больного и их процентной доли в лейкоформуле). Если же за пределы нормы выходит только процентное содержание, то говорят об относительном изменении лейкограммы.
Нейтрофилы
Нейтрофилез, или нейтрофильный лейкоцитоз, наблюдается при:
- гнойных заболеваниях;
- бактериальных, грибковых и паразитарных инфекциях;
- интоксикации;
- заболеваниях, протекающих с некрозом ткани (в том числе инфаркте миокарда или легкого и инсульте);
- состояниях после кровотечения;
- диабетической коме;
- тяжелой почечной недостаточности;
- приеме глюкокортикоидных гормональных препаратов.
Юные формы – палочкоядерные лейкоциты – активнее всего отвечают на воспаление и гнойный процесс. Когда в периферической крови растет количество палочкоядерных нейтрофилов, врачи говорят о палочкоядерном сдвиге, или сдвиге лейкограммы влево.
Нейтропения отмечается при:
- апластической анемии;
- агранулоцитозе;
- лечении цитостатиками (химиотерапии) и лучевой терапии;
- вирусных инфекциях (гепатит, корь, краснуха, грипп);
- хронических бактериальных инфекциях (стрепто– и стафиллококковых, туберкулезе, бруцеллезе);
- грибковых инфекциях;
- инфекциях, вызванных простейшими (гситоплазмоз, токсоплазмоз, малярия);
- постифекционных состояниях.
Эозинофилы
Эозинофилия – повышение содержания эозинофилов в периферической крови выше 0, 40 109/л у взрослых и 0,70 109/л у детей. Отмечается при:
- аллергических состояниях: астме, крапивнице, поражениях кожи, сенной лихорадке, глистных инвазиях (особенно трихинеллезе, стронгилоидозе), в отдельных случаях под влиянием антибиотиков (пенициллина, стрептомицина);
- инфекционных заболеваниях (скарлитина, сифилис, туберкулез);
- сниженной функции щитовидной железы;
- ревматизме;
- эритреме;
- остром лейкозе;
- паразитарных заболеваниях.
Эозинопения – понижение содержания эозинофилов меньше 0,05 109/л сигнализирует о пониженной сопротивляемости организма к воздействию неблагоприятных факторов. Такие показатели отмечаются при:
- отдельных инфекционных заболеваниях (брюшной тиф, дизентерия);
- остром аппендиците;
- сепсисе;
- травмах;
- ожогах;
- хирургических вмешательствах;
- в первые сутки развития инфаркта миокарда.
Кроме того, эозинопения отмечается в случае:
- физического перенапряжения;
- воздействия гормонов надпочечников и АКТГ;
- реакции на различные стрессы.
Базофилы
Базофилия – увеличение содержания базофильных лейкоцитов более 0,30 109/л – отмечается при:
- аллергических состояниях;
- длительных воздействиях малых доз излучения (например, у рентгенологов);
- заболеваниях системы крови;
- понижении функции щитовидной железы.
Кроме того, следует помнить о физиологической базофилии у женщин в предменструальный период.
Базопения – уменьшение содержания базофильных лейкоцитов ниже 0,01 109/л – отмечается при:
- повышенной функции щитовидной железы;
- беременности;
- стрессовых воздействиях;
- синдроме Иценко-Кушинга;
- острых инфекциях;
- остром воспалении легких.
Моноциты
Моноцитозом считается состояние, при котором уровень содержания моноцитов выше 1,00 109/л. Он наблюдается при:
- тяжело протекающих инфекциях (туберкулезе, сифилисе);
- ряде заболеваний системы крови;
- росте злокачественных новообразований;
- коллагенозах (ревматизме, системной красной волчанке);
- выздоровлении после острых состояний;
- хирургических вмешательствах.
Моноцитопения считается признаком поражения костного мозга, тогда содержание этих клеток не превышает 0,03 109/л.
Лимфоциты
Лимфоцитозом называют состояние, при котором содержание лимфоцитов в периферической крови становится выше 4,00 109/л у взрослых и 9,00 109/л у детей. Лимфоцитоз характерен для:
- ряда инфекций: бруцеллеза, брюшного и возвратного эндемического тифа, сифилиса, туберкулеза;
- хронического лимфолейкоза.
Врачи читают лимфоцитоз положительным признаком в случае заболевания туберкулезом, а лимфопению – отрицательным.
Лимфопения – снижение содержания лимфоцитов меньше 1,00 109/л отмечается при:
- вторичных иммунодефицитах;
- отдельных формах лейкоза;
- лимфогранулематозе;
- длительном голодании, сопровождающемся дистрофией;
- приеме кортикостероидов;
- длительном стрессе;
- почечной недостаточности.
Тромбоциты
Тромбоциты также называют кровяными пластинками. Их размер не выходит за пределы 1–3 мкм. Это самые мелкие клеточные элементы крови, чьей родоначальницей в костном мозге является относительно крупная клетка под названием мегакариоцит. Тромбоциты отшнуровываются от цитоплазмы мегакариоцита. Они циркулируют в периферической крови как нормальные зрелые пластинки. В норме их должно содержаться примерно 250 (180—320) 109/л. Тромбоциты – важнейший элемент системы свертывания крови (см. следующую главу), из-за их нехватки время кровотечения резко увеличивается, а сосуды становятся хрупкими и теряют эластичность.
Поэтому тромбоцитопения – снижение содержания кровяных пластинок меньше 100 109/л – всегда считается тревожным признаком. Она сигнализирует о следующих состояниях:
- подавлении образования новых мегакариоцитов;
- нарушении продукции тромбоцитов (алкоголизм, мегалобластные анемии, прелейкемический синдром);
- накоплением тромбоцитов в селезенке;
- тиреотоксикозе и гипотиреозе;
- воздействии медикаментов, подавляющих функции костного мозга;
- повышенном разрушении и (или) утилизации тромбоцитов.
В свою очередь, тромбоцитоз, при котором содержание пластинок возрастает, может сопровождать:
- хронические воспалительные процессы;
- острые инфекции;
- геморрагии;
- гемолиз;
- онкологические болезни крови;
- рост злокачественных образований.
Глава 2. Исследование свертывающей системы крови
Свертывание крови – результат работы тех систем, которые обеспечивают нам гемостаз, или нормальное состояние крови в кровеносном русле. Вообще-то этих систем три:
1) свертывающая;
2) противосвертывающая;
3) фибринолитическая.
Как можно понять из их названий, коагуляции противодействуют антикоагуляция и фибринолиз (разрушение образовавшихся тромбов). Свертывание крови – одно из важнейших приспособлений, выработанных нашим организмом в процессе эволюции. Без этого для нас был бы смертельным любой порез или ссадина. Сгусток крови не только закупоривает поврежденный сосуд и предотвращает потерю крови, но и образует впоследствии струп, защищающий поврежденные ткани от воздействия внешней среды, пока идет процесс заживления.
В процесс свертывания крови вовлечено много веществ. Двенадцать из них называются факторами свертываемости, но по принятой классификации они пронумерованы римскими цифрами от I до XIII, поскольку факторы V и VI выполняют одну и ту же функцию (см. табл. 2). Тем не менее и этот список можно считать неполным, поскольку в процессе задействован еще ряд веществ, например АДФ и серотонин. Поэтому проще будет кратко описать то, как образуется сгусток крови и что с ним происходит потом.
Образование сгустка начинается с тромбоцитарно-сосудистой стадии. Начальное повреждение стенок сосудов вызывает сжатие, или спазм, а также изменение их свойств. Грубо говоря, стенки становятся «липкими», то есть возрастают их адгезивные (склеивающие) свойства. Благодаря этому тромбоциты начинают во множестве прилипать к внутренней поверхности сосуда. При этом они изменяются, набухают и образуют все более крупные агрегаты. То есть происходит их агрегация. Данная фаза сопровождается активным выбросом в кровь биологически активных веществ, усиливающих адгезию и агрегацию тромбоцитов. Образуется так называемый первичный рыхлый тромбоцитарный тромб.
Далее следует стадия коагуляции. Хотя она длится дольше, чем предыдущая, но запускается уже через 30 сек. после повреждения сосуда. Эта стадия запускает каскадную реакцию, вовлекающую многочисленные факторы свертывания крови, подобно падению домино. Самая важная вещь на этом этапе – химическое преобразование (благодаря тем же факторам свертывания) растворенного в плазме фибриногена в волокна фибрина (см. табл. 2). Эти волокна «заманивают» в ловушку эритроциты и лейкоциты и таким образом уплотняют сгусток, который соответственно приобретает красный цвет. Процесс делят на три фазы:
1. Образование тромбопластина, или тромбокиназы, которую выбрасывают в кровь как поврежденные клетки стенок сосуда (тканевой тромбопластин), так и сами тромбоциты (кровяной тромбопластин).
2. При взаимодействии тромбопластина с протромбином образуется тромбин.
3. Тромбин завершает необратимую реакцию: он расщепляет фибриноген и преобразует его в фибрин.
Таблица 2
Факторы свертывания крови

Как и прочие системы организма, система гемостаза основана на сохранении равновесия между свертывающей и противосвертывающей системами. В последнюю входят следующие компоненты:
1. Простациклин (вещество, препятствующее адгезии и агрегации тромбоцитов).
2. Антитромбин III (вещество, активирующее факторы свертывания крови).
3. Гепарин – вещество, подавляющее образование кровяного тромбопластина и превращение фибриногена в фибрин).
После того как сгусток крови образовался и вы полнили свои кровоостанавливающие и защитные функции, организму необходимо избавиться от него, то есть запустить фибринолитическую систему. Этот сложный ферментативный процесс происходит под воздействием плазмина. В крови плазмин содержится в неактивной форме в виде так называемого плазминогена. Он преобразуется в плазмин под влиянием ряда активаторов, обнаруженных в самых различных тканях.
Показатели сосудисто-тромбоцитарной стадии свертывания
Длительность кровотечения
Как уже говорилось выше, эта стадия характеризуется образованием рыхлой тромбоцитарной пробки. Получить общее представление об эффективности этого процесса позволяет определение длительности кровотечения.
Для этого прокалывают мочку уха на глубину примерно 3,5 мм, после чего каждые 20—30 сек. стерильной фильтровальной бумагой с уха снимают выступающую капельку крови. В норме появление новых капель прекращается через 2–4 мин. после прокола. Это и есть время (длительность) кровотечения. Увеличение данного показателя прежде всего говорит либо о тромбоцитопении, либо об изменении свойств тромбоцитов или сосудистой стенки.
Образование первичной рыхлой пробки обеспечивается адгезией и агрегацией тромбоцитов, о которых можно судить по определяемым в лаборатории индексу адгезивности (в норме он равен 20—50%) и спонтанной или индуцированной агрегации тромбоцитов. В норме спонтанная агрегация либо не наблюдается, либо весьма незначительна. Она повышается при:
- атеросклерозе;
- тромбозах;
- предтомботических состояниях;
- инфаркте миокарда;
- сахарном диабете.
Ретракция кровяного сгустка
В результате коагуляции кровь образует сгусток, при сокращении выделяющий сыворотку. О сокращении, или ретракции кровяного сгустка, судят по объему выделенной при этом сыворотки. Индекс ретракции в норме равен 0,3–0,5 и уменьшается вследствие уменьшения количества тромбоцитов или их функциональных дефектах.
Показатели стадии коагуляции (плазменной стадии гемостаза)
Время свертывания
Общее представление о функциональном состоянии системы коагуляции дает время свертывания цельной крови. Проще всего его можно определить методом Моравица. На часовое стекло наносят каплю крови, взятую из пальца. Каждые 30 сек. по поверхности капли проводят запаянным стеклянным капилляром. Время, когда за капилляром потянутся фибриновые нити, и будет временем свертывания.
Кроме метода Моравица существует еще более 30 методов определения времени свертывания крови, из-за чего норма свертываемости может колебаться от 2 до 30 мин. Унифицированными считаются метод Сухарева (норма 2–5 мин.) и метод Ли-Уайта (норма 5–8 мин.). Свертываемость крови понижена при:
- ряде заболеваний печени;
- апластической анемии;
- гемофилии.
Примерно те же характеристики имеет и время рекальцификации плазмы. Его изменения сигнализируют о тех же заболеваниях, что и изменения свертываемости крови. В норме этот показатель колеблется от 60 до 120 сек.
Толерантность плазмы к гепарину
В отличие от времени свертывания, толерантность плазмы к гепарину говорит не только об общем состоянии системы коагуляции, но и косвенно характеризует содержание в крови протромбина. Этот показатель измеряется временем образования сгустка фибрина после добавления гепарина и хлорида кальция. В норме он равен 7–15 мин. Понижение толерантности плазмы к гепарину фиксируется при увеличении этого времени больше 15 мин.
Активированное частичное тромбопластиновое время (АЧТВ)
Это отрезок времени, за который сгусток фибрина образуется в плазме, бедной тромбоцитами. Определение АЧТВ – весьма чувствительный метод, характеризующий интенсивность выработки тромбопластина. У здорового взрослого человека это время равно 30—40 сек. Показатель заметно меняется в течение суток: повышается утром и понижается к вечеру.
Протромбиновое время
Это время образования сгустка фибрина при добавлении хлорида кальция и тканевого стандартизированного тромбопластина. Результат можно выразить в секундах (норма 11—15 сек.) или в виде протромбинового индекса (сравнив с протромбиновым временем здорового человека). В системе СИ в норме протромбиновый индекс равен 0,93–1,07. Увеличение протромбинового времени наблюдается при:
- заболеваниях печени;
- дефиците витамина К;
- внутрисосудистом свертывании крови;
- фибриногенолизе;
- повышении уровня антитромбина;
- некоторых онкологических заболеваниях;
- геморрагической болезни новорожденных;
- эритроцитозе;
- дефиците фактора IX.
Содержание фибриногена
Фибриноген – растворимая форма предшественника нерастворимого фибрина – главного компонента кровяного сгустка. Концентрация фибриногена в крови в норме равна 2–4 г/л и повышается при:
- инфаркте миокарда;
- предтромботических состояниях;
- ожогах;
- в последнем триместре беременности;
- после родов;
- хирургических вмешательствах;
- воспалительных процессах;
- злокачественных новообразованиях.
Понижение концентрации фибриногена, как правило, сигнализирует о тяжелых дисфункциях печени.
Показатели фибринолитической активности
Интенсивность фибринолиза определяют по скорости растворения сгустка фибрина. Для этого можно использовать так называемый эуглобулиновый метод, в норме дающий время лизиса эуглобулинового сгутска 3–4 ч. Есть также более простой метод Котовщиковой, по нему норма колеблется от 12 до 16%.
Активация фибиринолиза (сокращение времени лизиса) наблюдается при:
- внутрисосудистом свертывании крови;
- циррозе печени;
- раке простаты;
- оперативном вмешательстве на простате;
- шоке;
- хирургических вмешательствах на ткани легких;
- «акушерских осложнениях.
Угнетение фибринолиза (удлинение времени лизиса) говорит о:
- геморрагическом васкулите;
- тромбозе;
- гипо– и апластических процессах кроветворения.
Глава 3. Микробиологическое исследование крови
Медицинская микробиология
Микробиология – это раздел биологии, занимающийся изучением микроорганизмов, главным образом вирусов, бактерий, грибов (в особенности дрожжей), одноклеточных водорослей и простейших. Эта разнородная, искусственно объединенная группа микроскопически малых организмов составляет предмет одной науки в силу того, что для их изучения используются методы, первоначально разработанные для исследования бактерий. В основе микробиологических методов лежит получение чистых культур, выращенных из одной клетки. (Способы культивирования клеток многоклеточных организмов тоже заимствованы из бактериологии.) Создателем микробиологии считается Луи Пастер (1822—1825). Различают общую, медицинскую и техническую микробиологии. Медицинская микробиология – раздел микробиологии, изучающий болезнетворные организмы. В курсы медицинской микробиологии обычно включают также иммунологию и изучение более крупных паразитов, таких как черви и насекомые.
Многие микробы патогенны для человека, животных и растений и являются причиной разнообразных заболеваний. Медицинская микробиология изучает пути распространения инфекции, чувствительность возбудителей инфекционных болезней к антибиотикам и механизмы их патогенного действия. В клинических лабораториях при обследовании больных обычно проводят высевание и культивирование патогенных микробов, чтобы их затем идентифицировать и подобрать эффективное лечение. Другое прикладное направление – промышленная микробиология (получение антибиотиков, использование микроорганизмов при обработке пищевых продуктов, предохранение материалов от порчи и разложения, облагораживание почвы, извлечение металлов из руд и промышленных отходов, разработка способов получения белка из нефти). Наконец, сельскохозяйственная микробиология специализируется на повышении плодородия почвы и предупреждении болезней сельскохозяйственных животных.
Метаболическая активность микроорганизмов очень высока: они осуществляют фиксацию азота воздуха и тем самым повышают плодородие почвы; вносят основной вклад в фотосинтетическую продуктивность Мирового океана; разрушают органические отходы и продукты жизнедеятельности человека, обеспечивая их рециклизацию.
Бактериологическая лаборатория и бактериологическое иссследование
Бактериологическая лаборатория – подразделение, выполняющее микробиологические исследования. Существуют клинические, санитарно-бактериологические, контрольные, ветеринарные, сельскохозяйственные, пищевые и другие бактериологические лаборатории.
Бактериологическое исследование – совокупность методов, применяемых для обнаружения и установления природы бактерий, выделенных от больных, бактерионосителей или из объектов окружающей среды. Бактериологическое исследование проводят с диагностической целью при инфекционных болезнях, а также при обследовании на бактерионосительство и определении санитарно-гигиенического состояния объектов окружающей среды.
Выбор материала для бактериологического исследования определяется целью исследования, биологическими свойствами микробов, условиями обитания их в исследуемом объекте, патогенезом заболевания (с учетом места наибольшей концентрации возбудителя и путей его выведения из организма). Так, при сепсисе или болезни, сопровождающейся бактериемией (например, при брюшном тифе), для обнаружения возбудителя берут кровь, при дизентерии – испражнения, при пневмонии – мокроту, при подозрении на анаэробную инфекцию – материал из глубоких слоев тканей и т. д. Успех бактериологического исследования в значительной степени зависит от правильности взятия материала и соблюдения определенной осторожности при его транспортировке. У больного материал для исследования рекомендуется брать до начала лечения химиотерапевтическими препаратами. Исследуемый материал собирают в стерильную посуду, соблюдая правила асептики, и в возможно короткие сроки доставляют в бактериологическую лабораторию. Транспортировку инфицированного материала производят в закрытой посуде, помещенной в специальные биксы, пеналы, чемоданы и т. д. К материалу, посылаемому для бактериологического исследования, прилагают сопроводительный документ, включающий следующие сведения: характер направляемого материала и дату его взятия, фамилию, имя, отчество, возраст и адрес больного, дату начала заболевания, предполагаемый клин, диагноз. Доставленный в лабораторию материал необходимо как можно быстрее исследовать.
Бактериологическое исследование материала начинается с его бактериоскопии. Исследование под микроскопом окрашенных мазков (бактериоскопический метод) позволяет в некоторых случаях идентифицировать возбудителя заболевания (например, микобактерии туберкулеза, гонококки). Однако возможности этого метода ограничены и его обычно используют как ориентировочный.
Основным методом бактериологического исследования является бактериологический метод, который заключается в выделении чистой культуры возбудителя (популяции, содержащей бактерии одного вида) и ее идентификации. Под идентификацией микроорганизмов подразумевают изучение их свойств с целью установления принадлежности к той или иной систематической группе (роду, виду). Бактериологический метод представляет собой многоэтапное исследование. В связи с тем, что исследуемый материал чаще всего содержит смесь микроорганизмов, основой бактериологического метода является выделение чистой культуры возбудителя, которое производят на первом этапе исследования. С этой целью делают посев исследуемого материала, как правило, на плотные питательные среды, выбор которых обусловливается свойствами предполагаемого возбудителя. Применяют по возможности элективные среды, на которых растет только данный вид бактерий, или дифференциально-диагностические среды, позволяющие отличить предполагаемого возбудителя от других микроорганизмов. Например, для выделения дифтерийной палочки используют теллуритовые среды, при бактериологической диагностике кишечных инфекций – среду Эндо, висмут-сульфитный агар и т. д. При выделении условно-патогенных микроорганизмов посев материала производят на универсальные питательные среды, например кровяной агар. Все манипуляции, связанные с посевом и выделением бактериальных культур, осуществляют над пламенем горелки. Посев материала на питательные среды производят либо бактериальной петлей, либо стеклянным или металлическим шпателем таким образом, чтобы рассеять находящиеся в исследуемом материале бактерии по поверхности питательной среды, в результате чего каждая бактериальная клетка попадает на свой участок среды. При выделении чистой культуры возбудителя из патологического материала, в значительной мере загрязненного посторонней микрофлорой, иногда пользуются биологическим методом выделения чистой культуры: исследуемым материалом заражают чувствительных к возбудителю лабораторных животных. Так, при исследовании мокроты больного на содержание в ней пневмококков мокроту внутрибрюшинно вводят белым мышам и через 4–6 ч из их крови получают чистую культуру пневмококка. В том случае, если в исследуемом материале предполагается содержание малого количества возбудителя, для его накопления посев производят на жидкую питательную среду – среду обогащения (оптимальную для данного микроорганизма). Затем из жидкой питательной среды осуществляют пересев на плотные среды, разлитые в чашках Петри. Засеянную среду помещают в термостат обычно при t? 37? на 18—24 ч. Посевы анаэробов помещают в анаэростат, откуда удаляют воздух и заменяют его газовой смесью без кислорода.
На втором этапе проводят исследование колоний бактерий, происходящих от одной бактериальной клетки и выросших на плотной питательной среде (колония и является чистой культурой возбудителя). Производят макроскопическое и микроскопическое исследование колоний в проходящем и отраженном свете, невооруженным глазом, с помощью лупы, под малым увеличением микроскопа. Отмечают культуральные свойства колоний: их величину, форму, цвет, характер краев и поверхности, консистенцию, структуру. Далее часть каждой из намеченных колоний используют для приготовления мазков, окрашивают мазки по Граму, микроскопируют, определяя морфологические и тинкториальные (отношение к окраске) свойства выделенной культуры и одновременно проверяя ее чистоту. Оставшуюся часть колонии пересевают в пробирки со скошенным агаром (или другой оптимальной для данного вида средой) с целью накопления чистой культуры для более полного ее изучения. Пробирки помещают на 18—24 ч в термостат. Кроме перечисленных исследований на втором этапе нередко подсчитывают количество выросших колоний. Особенно большое значение это имеет при заболеваниях, вызванных условно-патогенными микроорганизмами, так как в этих случаях судить о ведущей роли того или иного возбудителя можно лишь по содержанию его в патологическом материале в большом количестве и преобладанию над другой флорой. Для проведения такого исследования готовят последовательные разведения исследуемого материала, из которых производят высев на чашки с питательной средой, подсчитывают число выросших колоний, умножают на разведение и таким образом определяют содержание микробов в материале.
Третий этап заключается в идентификации выделенной чистой культуры возбудителя и определении его чувствительности к антибиотикам и другим химиотерапевтическим препаратам. Идентификацию выделенной бактериальной культуры осуществляют по морфологическим, тинкториальным, культуральным, биохимическим, антигенным, токсигенным свойствам. Прежде всего делают мазок из культуры, выросшей на скошенном агаре, изучают морфологию бактерий и проверяют чистоту культуры бактерий. Затем производят посев выделенной чистой культуры бактерий на среды Гисса, желатин и другие среды для определения биохимических свойств. Биохимические, или ферментативные, свойства бактерий обусловлены ферментами, участвующими в расщеплении углеводов, белков, вызывающими окисление и восстановление различных субстратов. Причем каждый вид бактерий продуцирует постоянный для него набор ферментов. При изучении антигенных свойств чаще всего используют реакцию агглютинации на стекле. Токсинообразование микробов определяют с помощью реакции нейтрализации токсина антитоксином in vitro или in vivo. В некоторых случаях изучают и другие факторы вирулентности. Перечисленные исследования позволяют определить вид или род возбудителя.
С целью выявления эпидемической цепочки заболевания, в том числе для обнаружения источника инфекции, осуществляют внутривидовую идентификацию бактерий, которая заключается в определении фаготипа (фаговара), изучении антигенных и других свойств выделенных бактерий. Определение фаготипа – фаготипирование производят при стафилококковой инфекции, брюшном тифе, паратифе В. На чашку с питательной средой, засеянную с помощью шпателя (газоном) выделенной чистой культурой, наносят по капле различные диагностические фаги. Если культура чувствительна к данному фагу, наблюдается образование округлой формы участков разрушенных бактерий – так называемые бактериологического исследования негативные колонии (бляшки). Культура возбудителя может быть чувствительна к одному или нескольким фагам.
Для назначения рациональной химиотерапии в связи с широким распространением лекарственно-устойчивых форм бактерий необходимо определение антибиотикограммы – чувствительности или устойчивости выделенной чистой культуры возбудителя к химиотерапевтическим препаратам. С этой целью используют либо метод бумажных дисков, либо более точный, но громоздкий метод серийных разведений. Метод бумажных дисков основан на выявлении зоны подавления роста бактерий вокруг дисков, пропитанных антибиотиками. При применении метода серийных разведений антибиотик разводят в пробирках с жидкой питательной средой и засевают в них одинаковое количество бактер бактериологического исследования. Учет результатов проводят по отсутствию или наличию роста бактерий. Полученная антибиотикограмма может служить и эпидемиологическим целям для определения идентичности штаммов.
При выявлении бактерионосительства проводят повторные исследования, т. к. в одной порции материала можно не обнаружить возбудителя.
В настоящее время существуют ускоренные методы идентификации бактерий. Так, в нашей стране применяют СИБ (систему индикаторных бумажек), позволяющую быстро (через 6–12 ч.) и без использования большого числа питательных сред идентифицировать чистую бактериальную культуру. Для экспресс-диагностики инфекционных болезней широко используют иммунофлюоресцентный метод (см. Серологические исследования).
Глава 4. Анемии и связанные с ними анализы крови
Анеми€и (греч. ??????€? малокровие) – группа клинико-гематологических синдромов, общим моментом для которых является снижение концентрации гемоглобина в крови, чаще при одновременном уменьшении числа эритроцитов (или общего объема эритроцитов). Термин «анемия» без детализации не определяет конкретного заболевания, т. е. анемию следует считать одним из симптомов различных патологических состояний.
Сама по себе любая анемия не является заболеванием, но может встречается как синдром при целом ряде заболеваний, которые могут быть либо связаны с первичным поражением системы крови, либо не зависеть от него. В связи с этим для классификации анемий принято использовать принцип практической целесообразности. Для этого наиболее удобно делить анемии по единому классификационному признаку – цветовому показателю.
Средний корпускулярный объем (СКО)
В связи с переходом на автоматический анализ состава периферической крови цветовой показатель может быть с неменьшим успехом заменен на другой показатель – средний корпускулярный объем (СКО), измеряемый в фемтолитрах, или мкм3 (fl, фл). Его измеряют прямым способом с помощью автоматизированного счетчика. Нормальное значение СКО представляет 80—90 фл (нормоцитоз). Снижение СКО менее 80—95 фл – микроцитоз. Повышение СКО выше 95 фл – макроцитоз.
Снижение концентрации гемоглобина в крови часто происходит при одновременном уменьшении количества эритроцитов и изменением их качественного состава. Любая анемия приводит к снижению дыхательной функции крови и развитию кислородного голодания тканей, что чаще всего выражается такими симптомами, как бледность кожных покровов, повышенная утомляемость, слабость, головные боли, головокружение, сердцебиение, одышка и другими.
При рутинном исследовании мазка периферической крови морфолог указывает на отклонение размера эритроцитов в меньшую сторону (микроцитоз) или в большую сторону (макроцитоз), но такая оценка, если она производится без специальных приспособлений – микрометров, не может быть свободна от субъективизма. Достоинством автоматического анализа крови является стандартизация показателя – СКО.
Замена цветового показателя на показатель СКО не нарушает привычной классификации анемий, построенной на основании цветового показателя.
Классификация и проявление анемий
По своим проявлениям анемии делятся на:
1) Гипохромные (микроцитарные):
- железодефицитная анемия;
- талассемии.
2) Нормохромные (микроцитарные):
- гемолитические анемии (когда скорость разрушения эритроцитов превышает скорость их продукции);
- постгеморрагическая (как результат потери крови вследствие кровотечения или кровоизлияния);
- неопластические заболевания костного мозга;
- апластические анемии;
- внекостномозговые опухоли;
- анемии вследствии снижения выработки эритропоэтина.
3) Гиперхромные (макроцитарные):
- витамин B12-дефицитная анемия;
- фолиеводефицитная анемия;
- миелодиспластический синдром;
- лекарственные анемии.
4) Анемии при хронических воспалениях:
- при инфекциях:
+ туберкулез;
+ бактериальный эндокардит;
+ бронхоэктатическая болезнь;
+ абсцесс легкого;
+ бруцеллез;
+ пиелонефрит;
+ остеомиелит;
+ микозы;
- при коллагенозах:
+ системная красная волчанка;
+ ревматоидный артрит;
+ узелковый полиартериит;
+ болезнь Хортона.
Нередко анемия протекает без выраженных проявлений и часто остается незамеченной, во многих случаях становясь случайной лабораторной находкой у лиц, не предъявляющих специфических жалоб.
Как правило, страдающие анемией отмечают проявления, обусловленные развитием анемической гипоксии. При легких формах это может быть слабость, быстрая утомляемость, общее недомогание, а также снижение концентрации внимания. Люди с более выраженной анемией могут жаловаться на одышку при незначительной или умеренной нагрузке, сердцебиения, головную боль, шум в ушах, могут также встречаться нарушения сна, аппетита, полового влечения. При очень сильной анемии возможно развитие сердечной недостаточности.
Часто встречаемым диагностически важным симптомом умеренной или выраженной анемии является бледность (кожных покровов, видимых слизистых и ногтевых лож). Также ценное значение имеют такие симптомы, как усиление сердечного толчка и появление функционального систолического шума.
Проявления острых и тяжелых анемий всегда более выражены, чем хронических и средней тяжести.
Кроме общих симптомов, непосредственно связанных с гипоксией, у анемий могут быть и другие проявления – в зависимости от их этиологии и патогенеза. Например, развитие нарушений чувствительности при B12-дефицитной анемии, желтуха – при гемолитической анемии и пр.
В клинической практике используют различные расчетные величины, отражающие физико-химические свойства эритроцитов, позволяющие количественно характеризовать важные показатели состояния эритроцитов. Их вычисляют, исходя из величины гематокрита, концентрации гемоглобина, количества эритроцитов.
Средний объем эритроцита (MCV – Mean Corpuscular Volume)
MCV – средний корпускулярный объем – средняя величина объема эритроцитов, измеряемая в фемтолитрах или мкм3 (fl, фл). Его вычисляют путем деления гематокритной величины (суммы клеточных объемов) на общее количество эритроцитов в крови. На основании значений MCV дифференцируют анемии (микроцитарные, нормоцитарные и макроцитарные) для выбора терапии. Это более точный параметр, чем визуальная оценка размера эритроцитов, однако он не является достоверным при большом количестве эритроцитов с измененной формой.
Изменения MCV могут дать полезную информацию о нарушениях водно-электролитного баланса. Повышенное значение MCV свидетельствует о гипотоническом характере нарушений водно-электролитного баланса, тогда как понижение – о гипертоническом характере.
Значения MCV в норме: 75—95 фл.
Заболевания и состояния, сопровождающиеся изменением MCV:
Значения MCV < 80 fl:
1) Микроцитарные анемии:
- железодефицитные анемии;
- талассемии;
- сидеробластные анемии.
2) Анемии, которые могут сопровождаться микроцитозом:
- гемоглобинопатии;
- нарушения синтеза порфиринов
- отравление свинцом
Значения MCV > 80 fl и < 100 fl:
1) Нормоцитарные анемии:
- апластические;
- гемолитические;
- гемоглобинопатии;
- анемии после кровотечений.
2) Анемии, которые могут сопровождаться нормоцитозом:
- регенераторная фаза железодефицитной анемии.
Значения MCV > 100 fl:
1) Макроцитарные и мегалобластные анемии:
- дефицит витамина В12, фолиевой кислоты.
2) Анемии, которые могут сопровождаться макроцитозом:
- миелодиспластические синдромы;
- гемолитические анемии;
- болезни печени.
Среднее содержание гемоглобина в эритроците (MCH – Mean Corpuscular Hemoglobin)
Этот показатель отражает абсолютное содержание гемоглобина в одном эритроците, выражаемый в пикограммах (пг). Его определяют путем деления концентрации гемоглобина на число эритроцитов в одинаковом объеме крови. Это истинный показатель дефицита железа в организме или неусвоения железа эритробластами и нарушения синтеза гема (сидеробластные анемии). МСН самостоятельного значения не имеет и всегда соотносится с MCV и МСНС. На основании этих показателей различают нормо-, гипо– и гиперхромные анемии.
Снижение среднего содержания гемоглобина в эритроците (гипохромия) наблюдается вследствие уменьшения объема эритроцитов (микроциты) или понижения содержания гемоглобина в нормальном по объему эритроците.
Нормохромия (нормальное содержание гемоглобина в эритроците) обычно имеет место у здоровых людей, но может отмечаться и при некоторых анемиях (острых постгеморрагических, гемолитических и апластических).
Содержание гемоглобина в эритроците в норме: 27—31 пг.
Cнижение МСН (гипохромия):
- гипохромные и микроцитарные анемии (железодефицитная, анемия при хронических болезнях);
- талассемия;
- некоторые гемоглобинопатии;
- свинцовое отравление;
- нарушение синтеза порфиринов.
Повышение МСН (гиперхромия):
- расстройства обмена витамина В12 или его дефицита (мегалобластные анемии);
- многие хронические гемолитические анемии;
- гипопластическая анемия после острой кровопотери;
- гипотиреоз;
- заболевания печени;
- метастазы злокачественных новообразований;
- прием цитостатиков, контрацептивов, противосудорожных препаратов.
Средняя концентрация гемоглобина в эритроците (MCHC – Mean Corpuscular Hemoglobin Concentration)
МСНС – отражает степень насыщения эритроцита гемоглобином; характеризует отношение количества гемоглобина к объему клетки (не зависит от объема клетки, в отличие от МСН), выражается в г/л.
МСНС используют для дифференциальной диагностики анемий. Снижение показателя отражает абсолютную гипохромию.
Средняя концентрация гемоглобина в эритроците в норме: 300—380 г/л.
Снижение МСНС:
- гипохромные железодефицитные и сидеробластические анемии
- талассемия;
- гипоосмолярные нарушения водно-электролитного обмена;
- заболевания, сопровождающиеся нарушением синтеза гемоглобина (гемоглобинопатии);
- мегалобластные анемии (когда увеличение объема эритроцитов значительнее насыщения эритроцитов гемоглобином).
Повышение МСНС:
- гиперхромные анемии (сфероцитоз, овалоцитоз);
- гиперосмолярные нарушения водно-электролитного обмена.
Трансферрин
Трансферрин (сидерофилин) – белок в плазме крови, основной переносчик железа. Насыщение трансферрина происходит благодаря его синтезу в печени и зависит от содержания железа в организме. С помощью анализа трансферрина можно оценить функциональное состояние печени. Норма трансферрина в сыворотке крови – 2,0–4,0 г/л. Содержание трансферрина у женщин на 10% выше, уровень трансферрина увеличивается при беременности и снижается у пожилых людей.
Повышенный трансферрин – симптом дефицита железа (предшествует развитию железодефицитной анемии в течение нескольких дней или месяцев). Повышение трансферрина происходит вследствие приема эстрогенов и оральных контрацептивов.
Пониженный трансферрин в сыворотке крови – повод для врача поставить следующий диагноз:
- хронический воспалительный процесс;
- гемохроматоз;
- цирроз печени;
- ожог;
- злокачественная опухоль;
- избыток железа.
Повышение трансферрина в крови происходит также в результате приема андрогенов и глюкокортикоидов.
Железосвязывающая способность сыворотки крови
Железосвязываюшая способность сыворотки крови (ЖСС) – показатель, характеризующий способность сыворотки крови к связыванию железа. Железо в организме человека находится в комплексе с белком – трансферрином. ЖСС показывает концентрацию трансферрина в сыворотке крови. Железосвязывающая способность сыворотки крови изменяется при нарушении обмена, распада и транспорта железа в организме. Для диагностики анемии используют определение латентной железосвязывающей способности сыворотки крови (ЛЖСС) – это ЖСС без сывороточного железа. Норма латентной ЖСС – 20—62 мкмоль/л.
Повышение уровня ЛЖСС происходит при дефиците железа, железодефицитной анемии, остром гепатите, на поздних сроках беременности.
Понижение ЛЖСС происходит при уменьшении количества белков в плазме (при нефрозе, голодании, опухолях), при хронических инфекциях, циррозе, гемахроматозе, талассемии.
Ферритин
Ферритин – основной показатель запасов железа в организме, играет важную роль в поддержании железа в биологически полезной форме. В состав ферритина входят фосфаты железа. Ферритин содержится во всех клетках и жидкостях организма. Анализ крови на ферритин используется для диагностики железодефицитной анемии и диагностики анемии, сопровождающей инфекционные, ревматические и опухолевые заболевания.
Норма ферритина в крови для взрослых мужчин – 30–310 мкг/л. Для женщин норма анализа крови на ферритин – 22–180 мкг/л.
Избыток ферритина в крови может быть следствием следующих заболеваний:
- избыток железа при гемохроматозе;
- алкогольный гепатит и другие заболевания печени;
- лейкоз;
- острые и хронические инфекционно-воспалительные заболевания (остеомиелит, инфекции легких, ожоги, ревматоидный артрит);
- рак молочной железы.
Повышение уровня ферритина происходит при приеме оральных контрацептивов и голодании. Низкий ферритин – следствие дефицита железа (железодефицитной анемии).
Лечение низкого ферритина всегда назначается только врачом: необходимо точно выяснить, какие нарушения привели к снижению ферритина в анализе крови.
Глава 5. Серологическое исследование крови
Серология (от лат. serum – сыворотка и...логия), буквально учение о свойствах сыворотки крови; обычно под «серологией» понимают раздел иммунологии, изучающий взаимодействие антител сыворотки с антигенами. В основе метода серологической диагностики лежит определение специфических антител, образовавшихся в процессе иммунного ответа на проникновение возбудителя заболевания (антигена).
Серологические реакции применяют в научных и диагностических целях в инфекционной и неинфекционной иммунологии: их используют, например, при переливании крови, для определения групп крови, установления видовой и индивидуальной специфичности белков. Серологические исследования применяют также в эпидемиологии и эпизоотологии для выявления источника инфекции, путей ее передачи, иммунитета у людей и животных, эффективности вакцинации и т. п. Реакция между антигенами и антителами лежит в основе серопрофилактики и серотерапии. Среди основных задач серологии – разработка методов получения высокоспецифических диагностических и лечебных сывороток, оценка их активности и выяснение механизма действия.
Группы крови
К сожалению, в жизни довольно часто складываются ситуации, чреватые обильной потерей крови (например, дорожные аварии или тяжелые операции), и единственный способ не потерять пациента состоит в том, чтобы возместить часть потерянного объема; без достаточного количества крови ткани не способны получить необходимые вещества, особенно кислород, необходимый для выживания (мозг, в частности, в отсутствие кислорода умирает очень быстро). Казалось бы, чего уж проще – взять немного крови от одного человека и передать ее другому; этот процесс называется переливанием (трансфузией) крови.
Естественно, такая мысль не могла не зародиться у медиков, которым приходилось сталкиваться с печальными последствиями обильной кровопотери, и первое успешное переливание крови было предпринято еще в 1667 г. во Франции неким Жан-Батистом Дени и его коллегой Эфферезом. Для переливания эти отважные люди использовали кровь ягненка. В результате им удалось спасти жизнь 16-летнему юноше. Однако сторонников этого метода ждало еще великое множество разочарований, потому что далеко не все попытки давали желаемый результат. Скорее даже наоборот: слишком часто пациенты погибали по непонятным для медиков причинам, обескураживая даже самых увлеченных энтузиастов. Таким образом наука подошла вплотную к объяснению несовместимости человеческой крови.
Но только эксперименты, проведенные в 1900—1907 гг. австрийцем К. Ландштейнером, окончательно определили систему групп крови у человека, тем самым положив конец осложнениям, являвшимся следствием несовместимости крови.
Прежде чем говорить о группах крови и резус-факторе, имеет смысл немного поговорить о генетике. Ген – это участок хромосомной ДНК, который кодирует специфический белок. Аллелями называют различные формы одного и того же гена, расположенные в одинаковых участках (локусах) гомологичных хромосом. Различные аллели определяют варианты развития одного и того же признака. Так как гены находятся на хромосомах, а хромосомы существуют парами, наши гены обычно присутствуют в виде пары аллелей.
Аллели могут быть доминантными или рецессивными, поэтому комбинация аллелей в паре определяет характерный признак. Доминантная аллель, обозначаемая заглавной буквой, определяет признак (например, цвет глаз) независимо от того, присутствует ли она в одной или двух копиях: WW или Ww. Рецессивная аллель, обозначаемая строчной буквой, определяет признак (например, голубые глаза) только в том случае, если присутствует в двух копиях: ww. Возможны следующие комбинации аллелей: WW, Ww и ww. Физическое проявление признака (например, тип роста волос) определяется набором генов: комбинации WW и Ww дают проявиться доминантным признакам (карие глаза), в то время как ww – рецессивным (голубые глаза).
Теперь о системах антигенов эритроцитов. Группы крови определяются антигенами (в этом случае – гликопротеинами, расположенными на мембране эритроцитов. Хотя в настоящее время известно 25 систем антигенов, важнейшими для человека все же остаются группы крови по системе АВ0 и резус-фактор (Rh). Наличие этих антигенов генетически обусловлено двумя генами: геном АВ0 и Rh-геном. Давайте начнем с Rh-фактора, получившего свое необычное название от обезьян резус, у которых и был впервые обнаружен.
Если унаследована аллель, определяющая образование этого гликопротеина (обозначенная Rh+), то он появится на мембране клетки. Существует и другая аллель (обозначенная Rh-), наличие которой означает отсутствие антигена. Единственный способ получить клетку без Rh-фактора состоит в том, чтобы обе гомологичные хромосомы содержали аллели Rh-. Следовательно, отрицательный резус-фактор – рецессивный признак. Вы будете Rh-положительным, если унаследовали по крайней мере одну Rh+ аллель (то есть «в сумме» ++ или +–).
Ген АВ0, который получил свое странное название от этих трех аллелей, определяет другой тип крови: A, B, ну и конечно 0. Этот ген иллюстрирует другую интересную вещь, которая иногда встречается в наследовании: некоторые гены – кодоминантны. Кодоминантными генами называются такие, у которых две аллели, например А и В, обе являются доминантными, и наличие в генотипе их обеих (АВ) определяет вариант, в котором проявляются оба признака, кодируемые этими генами (то есть гликопротеины А и B).
Подобно Rh-аллели, 0 (I) аллель может воспроизвести группу крови 0 только в том случае, если обе унаследованных аллели – 0 (00), то есть 0-аллель – рецессивная.
Таблица 3
Групповая принадлежность людей по системе АВ0
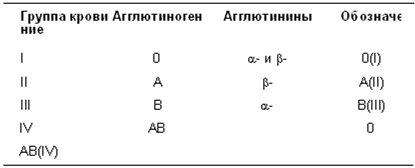
Групповая совместимость крови основывается на факте, что несовместимые образцы крови агглютинируют, или склеиваются при смешивании. Это происходит из-за присутствия антител, атакующих чужеродные поверхностные антигены (А, В или Rh+, но не 0 или Rh-) по этой причине поверхностные антигены иногда называют агглютиногенами, а антитела, находящиеся в плазме, называют агглютининами. Три антитела называют, и законно, анти-А (или – антитела), анти-B (или – антитела), и анти-Rh. – и – антитела всегда находят у людей с определенными группами крови (в таблице представлены варианты групп крови), даже без предшествующего присутствия чужеродного антигена, но анти-Rh вырабатывается иммунной системой только после встречи с антигеном.
Беглый взгляд на таблицу групп крови выявляет некоторые интересные особенности. Любая несовместимая группа крови должна иметь антиген, который является чуждым получателю. AB+ кровь содержит все три антигена (A, B, и Rh+), и ни одного антитела; также нет такого типа крови, который является несовместимым с AB+, универсальным реципиентом крови.
Большинству вообще из нас доводилось слышать, что группа 0(I) – универсальный донор, подразумевая под этим, что такую кровь можно без опасений переливать любому человеку. Это верно лишь отчасти. Вы не забыли, что есть кровь 0(I)+ и 0(I)-? Сверьтесь с таблицей. 0(I)+ имеет Rh-антиген, который будет чуждым любому пациенту с Rh– (А(II)-, В(III)-, АВ(IV)– и 0(I)-). И только группа 0(I)– вообще не имеет чужеродных антигенов, что и делает именно ее универсальным донором.
Таблица 4
Типы крови по содержащимся в них антителам и антигенам с учетом Rh-фактора

При переливании группа крови сперва определяется лечащим врачом и повторно врачом-лаборантом. Такая система двойного контроля позволяет избежать ошибок. Определение резус-принадлежности производится врачом-лаборантом. Данные о группе крови и резус-принадлежности выносятся на первую страницу истории болезни. Непосредственно перед переливанием делают пробу на индивидуальную совместимость крови донора и реципиента.
Даже если больному переливают кровь той же группы, во избежание осложнений врач делает биологическую пробу: вводит по 25 мл крови донора трехкратно, с перерывами по 3 мин. Если при этом у больного не отмечается отрицательная реакция (тревожность, неприятные ощущения), врач переливает намеченное им количество крови полностью.
После открытия резус-фактора, сделанного К. Ландштейнером и А. Винером в 1940 г., ученые смогли объяснить те случаи осложнений, которые отмечались даже при переливании правильно подобранных групп крови. После первого переливания Rh-отрицательному больному Rh-положительной крови у последнего вырабатывались антитела, которые склеивали и разрушали донорские эритроциты при повторной трансфузии. Позже было установлено, что резус-фактор, дающий положительную реакцию, содержится в крови примерно у 85% людей, остальные 15% являются резус-отрицательными.
Резус-фактор влияет не только на совместимость крови у донора и реципиента. Различиями в резус-принадлежности матери и плода объясняется тяжелое заболевание новорожденных – гемолитическая желтуха, развивающаяся в тех случаях, когда резус-отрицательная мать вынашивает резус-положительного ребенка.
Через плаценту в кровь матери проникают Rh+ эритроциты ребенка, и ее иммунная система реагирует на них как на чужеродные антитела, вырабатывая все больше и больше соответствующих антигенов. Эти антигены опять-таки через плаценту попадают в кровеносную систему плода и разрушают его эритроциты. Развивается ситуация, называемые резус-конфликт. В результате ребенок либо погибает еще в утробе, либо рождается тяжело больным.
Первый ребенок от резус-положительного отца и резус-отрицательной матери, как правило, рождается здоровым, но вторая и последующие беременности, равно как и аборт, многократно увеличивают вероятность развития резус-конфликта.
Вот почему в женских консультациях обязательно определяют резус-фактор для всех беременных. И беременная женщина с резус-отрицательной кровью остается под особым наблюдением: у нее постоянно проверяют титр антител, то есть содержание в крови антител к резус-положительным эритроцитам плода. Если титр возрастает, врач немедленно должен предпринять меры, тормозящие выработку антител.
Иммуноферментный анализ сыворотки крови (ИФА)
Различают антитела трех классов: иммуноглобулины M, A, G (JgМ, JgА, JgG). Они накапливаются в сыворотке крови и секретах организма через разные промежутки времени от начала инфицирования.
При первичном инфицировании первыми появляются иммуноглобулины класса М, которые выявляются методом ИФА с 5 дня от начала заболевания по 5–6 неделю, затем они в течение нескольких недель или месяцев исчезают из кровотока. Также иммуноглобулины класса М могут вырабатываться при активации хронической инфекции.
Иммуноглобулины класса G выявляются через 3–4 недели от начала первичного инфицирования или от момента обострения хронического заболевания и циркулируют в крови длительно, сохраняясь в течение нескольких месяцев или лет. Увеличение титров JgG в двух последовательно взятых пробах через 2 недели свидетельствует о текущей инфекции или реинфекции. Иммуноглобулинами класса G обеспечивается также постинфекционный или поствакцинальный иммунитет.
Иммуноглобулины класса А выявляются через 2–4 недели от момента инфицирования или обострения хронического заболевания. 20% от их общего количества циркулирует в сыворотке крови, 80% входит в состав секрета слизистых оболочек (их можно определить в семенной или вагинальной жидкостях). Через 2 недели – 2 месяца после изгнания и уничтожения инфекционного агента иммуноглобулины класса А исчезают из кровотока, что является критерием излеченности. Если JgA не исчезают после проведенного лечения, то это указывает на хроническую или персистирующую инфекцию.
У новорожденных и детей до 6–9 месяцев JgG в крови имеют материнское происхождение, так как еще не могут синтезироваться в организме ребенка. В то же время JgМ синтезируются в организме плода с 14-й недели развития, а материнские JgM не проникают через плаценту, поэтому определение специфических JgM в крови новорожденных свидетельствует о внутриутробном инфицировании.
Таблица 5
Интерпретация результатов анализов при исследовании иммуноглобулинов

(–) – отрицательный результат
(+) – положительный результат
Глава 6. Биохимическое исследование крови
Современные технологии, компьютеризация и автоматизация многих процессов разительным образом изменили характер работы клинико-диагностических лабораторий, и особенно явно это отражается на биохимических исследованиях.
Автоанализаторы значительно ускорили и упростили выполнение практически всех видов биохимических и других видов исследований, а их подключение к компьютерам позволяет быстро обобщать серии исследований для одного пациента, хранить в памяти все полученные результаты и подготовить обоснованный ответ клиницисту.
В России начат серийный выпуск специальных наборов реагентов для автоанализаторов. Все выпускаемые в настоящее время наборы, а также стандартные, контрольные, калибровочные образцы стандартизированы и зарегистрированы в Минздравсоцразвития РФ.
Все выпускаемые наборы подвергаются тщательной проверке в ведущих лабораториях и медицинских центрах и только после этого регистрируются. Такая стандартизация позволяет сделать сопоставимыми результаты исследований, полученные в самых разных медицинских учреждениях.
Показатели белкового обмена
Как уже говорилось выше, кровь состоит из жидкой компоненты и клеток, или форменных элементов. Кровь, набранная в сухую пробирку, через несколько минут разделится на сгусток темно-красного цвета и светло-желтую жидкость над сгустком. Это и будет сыворотка крови. В отличие от сыворотки плазма крови содержит белок фибриноген. Он переходит в сгусток крови во время коагуляции, а значит, чтобы получить плазму крови, нужно добавить в цельную кровь консервирующее вещество, препятствующее коагуляции, и только потом подвергнуть ее центрифугированию.
Кровь состоит на 45% из взвешенных в ней форменных элементов и на 55% из плазмы.
Пожалуй, для полноты картины здесь следует напомнить читателям и о межклеточной жидкости, окружающей клетки нашего тела. Конечно, кровь несет главную нагрузку в вопросе транспортировки веществ к и от тканей тела; но фактически клетки тканей получает вещества из кровеносных сосудов через жидкость, их окружающую. Эту жидкость и называют межклеточной жидкостью.
Растворенные в этой жидкости вещества, так же как часть молекул воды, входят в клетки, и таким же образом выходят в межклеточную жидкость из клеток. Кроме того, концентрация различных веществ в межклеточной жидкости может меняться (например, кислород входит в клетки, а углекислый газ выходит). Таким же самым образом концентрация веществ, растворенных в крови, отличается в капиллярных артериях и венах. За исключением кислорода и небольшого количества углекислого газа, все другие вещества, нуждающиеся в транспорте, передаются через плазму. Плазма в большей степени, чем клетки крови, связывает две циркуляторные системы нашего тела, сердечно-сосудистую и лимфатическую. И все вещества перемещаются по организму следующим путем: из плазмы – в межклеточную жидкость – в лимфу – и назад, в плазму. Важно понять, что эти жидкости: кровь, межклеточная жидкость и лимфа – являются по существу одним и тем же, несмотря на любые различия в концентрации; главное различие между ними – местоположение (точно так же, единственное различие между магмой и лавой – местоположение: магма находится под землей, а лава выходит на поверхность). Лимфатические капилляры – открытые сосуды, в стенках которых с известной периодичностью встречаются отверстия, являющиеся местами вхождения межклеточной жидкости. Лимфатическая жидкость в конечном счете соединяется с плазмой через грудной проток в подключичной вене.
В плазме содержится 92% воды, 7% белков и 1% других веществ (углеводов, жиров и минеральных солей). Тот факт, что вода является таким превосходным растворителем, позволяет крови переносить много растворенных веществ. Большинство этих веществ – плазменные белки. Это высокомолекулярные соединения, способные вести себя и как кислоты, и как основания благодаря тому, что их молекулы содержат и карбоксильные (кислотные группы СООН), и аминогруппы (основные группы NH2). Благодаря этим уникальным свойствам плазменные белки способны активно взаимодействовать с самым широким спектром различных веществ, поступающих в кровь.
По форме белки делятся на глобулярные и фибриллярные. Глобулярные белки хорошо растворимы в воде, их молекула имеет шарообразную форму. Фибриллярные белки плохо растворимы в воде и отличаются удлиненной, нитеобразной формой, так что их длина, в отличие от глобулярных белков, во много раз больше диаметра. Как и у любых органических соединений, у белков можно найти и переходные формы – между глобулярной и фибриллярной.
По составу различают простые и сложные белки. Простые белки состоят только из аминокислот. Это альбумины, глобулины, протамины, гистоны (два последних вида сосредоточены в клеточных ядрах и участвуют в регулировании метаболической активности отдельных генов) и некоторые другие.
Самые маленькие из этих белков (составляющие тем не менее приблизительно 60% от всех белков крови) – альбумины, которые играют важную роль в поддержании осмотического давления, помогая переместить больше воды из капилляров. Альбумины также участвуют в транспорте стероидных гормонов.
Приблизительно 35% белков плазмы представлены глобулинами. Они образуют антитела (?-глобулины), которые играют важнейшую роль в борьбе с инфекцией. Два других глобулина, ?– и ?-, транспортируют жиры, жирорастворимые витамины и железо. Приблизительно 7% плазменного белка составляет фибриноген, производимый печенью и являющийся важным участником процесса свертывания крови (см. предыдущую главу). Последний 1% состоит из регулирующих белков типа проферментов, ферментов и гормонов. Учитывая, что эндокринная система бессильна без кровеносной системы, может показаться немного несправедливым, что на долю гормонов приходится так мало плазмы.
Молекулы сложных белков содержат не только аминокислоты, но и другие соединения: нуклеиновые кислоты, форфорную кислоту, углеводы и т. д. Таким образом, нуклеопротеиды, глюкопротеиды, липопротеиды, хромопротеиды, фосфопротеиды и ряд ферментов мы классифицируем как сложные белки.
Остающиеся 1,5% плазмы представлены другими веществами: электролитами, газами, питательными веществами, регулирующими веществами, витаминами и продуктами метаболизма. Еще раз: их ужасно мало, но они тем не менее очень важны! Электролиты весьма разнообразны: Na+, K+, Са2+, Мg2+, Cl-, HCO3-, HPO42– и HSO42-. Ионы натрия и кальция (Na+ и Са2+), например, необходимы для сокращения мышц, а ионы бикарбоната (HCO3-) – для транспорта CO2 к легким.
Важнейшим свойством белков является их гидрофильность или способность связывать молекулы воды, образуя собственную водную оболочку и тем самым поддерживая коллоидно-осмотическое, или онкотическое давление. При резком падении содержания в крови белка онкотическое давление снижается, в кровеносном русле появляется избыточное количество «свободной» воды, которая начинает пропотевать через стенки сосудов в окружающие ткани. Так появляются онкотические отеки, т. е. отеки, зависящие от количества белка в крови.
Как уже говорилось выше, благодаря способности связываться со многими типами веществ белки плазмы крови выполняют и транспортные функции.
Кроме того, белки являются одной из буферных систем крови и поддерживают постоянство гомеостаза – кислотно-основное состояние (КОС) крови (см. ниже по тексту).
Общий белок
В сыворотке здоровых людей содержится 65—78 г/л общего белка. Это на 2–4 г/л меньше, чем в плазме крови – из-за отсутствия фибриногена. Общее количество белка может понижаться, и тогда врачи говорят о гипопротеинемии, которая наблюдается при:
- недостаточном поступлении белка в организм;
- повышенной потере белка;
- нарушении образования белка.
Альбумины
Благодаря различиям белков по аминокислотному составу и физико-химическим свойствам их можно разделить на отдельные фракции. Точнее всего такое разделение получается методом электрофореза.
У здоровых людей содержание альбумина составляет 56,5–66,8%, ?1– глобулина 3,5–6,0%, ?2-глобулина 6,9–10,5%, ?-глобулина 7,3–12,5%, ?-глобулина 12,8–19,0%.
Показания к использования этого анализа для диагностики патологических процессов:
- острые и хронические воспаления;
- заболевания печени;
- злокачественные образования;
- парапротеинемии;
- нефротический синдром;
- нарушение обмена липидов;
- недостаток антител.
Остаточный азот
Процесс синтеза или распада белков является основным компонентом азотистого обмена в организме и также влияет на состав сыворотки крови. Для оценки состояния азотистого обмена в сыворотке определяют фракции остаточного азота. Это так называемый небелковый азот, который остается в центрифугате сыворотки крови после осаждения белков соответствующими реактивами. В его состав входит ряд азотсодержащих веществ (мочевина, аминоазот (азот аминокислот), мочевая кислота, креатинин, индикан и др.). О методах исследования этих веществ будет рассказано ниже.
В норме содержание остаточного азота колеблется в пределах 0,2–0,4 г/л. Увеличение концентрации остаточного азота больше 0,4–0,5 г/л называется азотемией и считается признаком того, что азотистые шлаки либо задерживаются в крови (из-за нарушения работы почек), либо вырабатываются с повышенной скоростью (внепочечная азотемия).
С-реактивный белок (СРБ)
С-реактивный белок, или СРБ – очень чувствительный элемент крови, быстрее других реагирующий на повреждения тканей. Наличие реактивного белка в сыворотке крови – признак воспалительного процесса, травмы, проникновения в организм чужеродных микроорганизмов – бактерий, паразитов, грибов. С-реактивный белок стимулирует защитные реакции, активизирует иммунитет.
Содержание СРБ в сыворотке крови до 0,5 мг/л считается нормой. Уже через 4–6 часов после того, как в организм проникает инфекция, развивается воспалительный процесс, который может сопровождаться отеками, а уровень СРБ начинает быстро расти. Чем острее воспалительный процесс, активнее заболевание, тем выше С-реактивный белок в сыворотке крови. Когда заболевание в хронической форме переходит в фазу ремиссии, то содержание С-реактивного белка в крови практически не обнаруживается. Когда наступает обострение, СРБ снова начинает расти. Определение СРБ используется для диагностики острых инфекционных заболеваний и опухолей. Также анализ СРБ используется для контроля над процессом лечения, эффективностью антибактериальной терапии и т. д. Биохимический анализ крови СРБ может показать рост С-реактивного белка в крови в следующих случаях:
- ревматические заболевания;
- заболевания желудочно-кишечного тракта;
- рак;
- инфаркт миокарда;
- сепсис новорожденных;
- туберкулез;
- менингит;
- послеоперационные осложнения.
Повышение СРБ происходит при приеме эстрогенов и оральных контрацептивов.
Гомоцистеин
В процессе формирования атеросклероза состояние сосудистой стенки играет не меньшую роль, чем нарушения липидного обмена. Среди факторов, повреждающих стенки сосудов, в последнее время особое внимание привлекает гомоцистеин – промежуточный продукт обмена незаменимой аминокислоты метионина. В норме гомоцистеин живет в организме очень недолго и под действием ферментов с длинными названиями превращается обратно в метионин или в следующий продукт обмена, цистатионин. Различные нарушения в организме приводят к тому, что гомоцистеин в нем накапливается и вызывает ряд патологических эффектов, в частности – поражает внутреннюю стенку артерий. В результате образуются разрывы эндотелия (внутреннего слоя сосудистой стенки), которые организм пытается заживить. Для этого он и использует холестерин и другие липиды. Возможно, образование атеросклеротических бляшек – это патологическое развитие защитной реакции, направленной на устранение дефекта в стенке сосуда, и холестерин здесь не причина, а следствие, или даже защитник целостности стенок наших сосудов. Работа ферментов, участвующих в биохимических превращениях гомоцистеина, невозможна без кофакторов («помощников») – витаминов B6, B12 и B9 (фолиевой кислоты). В этом кроется возможный подход к профилактике и лечению атеросклероза с помощью витаминов группы B, прежде всего – фолиевой кислоты. Гомоцистеиновая теория весьма убедительно объясняет причины возникновения атеросклероза. Но пока холестериновая теория остается общепринятой, врачи и пациенты вопреки фактам, здравому смыслу и биохимии организма насмерть (в прямом смысле этого слова) бьются с веществом, без которого жизнь просто невозможна.
Норма гомоцистеина составляет 5–15 мкмоль/л. При концентрации гомоцистеина в плазме крови 15—30 мкмоль/л определяется умеренная степень гомоцистеинемии, 30–100 мкмоль/л – средняя, более 100 – тяжелая. Умеренная гомоцистеинемия в возрасте до 40 лет, как правило, протекает бессимптомно, однако изменения в коронарных и мозговых артериях уже происходят. Повышение гомоцистеина на 5 мкмоль/л увеличивает риск атеросклеротического повреждения сосудов сердца на 80% у женщин и на 60% у мужчин.
Для максимально правильного расчета риска сосудистых осложнений необходимо применять схему: гомоцистеин + фибриноген + С-реактивный белок + расширенный комплекс исследования липидного обмена (триглицериды, холестерин ЛПВП, ЛПНП, ЛПОНП, аполипротеин-А и В, индекс атерогенности).
Мочевина сыворотки крови
Мочевина – главный компонент фракции остаточного азота (см. предыдущий раздел) – составляет в ней примерно 50%. В норме содержание мочевины в сыворотке крови колеблется от 2,5 до 8,3 ммоль/л.
Изменение концентрации мочевины – важный диагностический признак при почечной патологии, поскольку он начинает меняться раньше, чем количество остаточного азота. Концентрация мочевины повышается при:
- почечной недостаточности;
- нефритах;
- питании с богатым содержанием белка.
Кроме того, концентрация мочевины повышается при некоторых состояниях, не связанных с патологией почек. Это может быть:
- простатит;
- непроходимость кишечника;
- ожоги;
- шок;
- всех патологиях, связанных с активным белковым распадом (опухоли, тяжелые инфекции, лихорадочные состояния, гипертиреоз).
Поскольку мочевина главным образом образуется в печени, то понятно, что при заболеваниях этого органа в первую очередь понижается и количество мочевины в крови. Уровень мочевины в крови понижается при:
- паренхиматозных желтухах;
- острой атрофии печени;
- циррозе печени.
Важное диагностическое значение имеет также мочевинный коэффициент – или процентное соотношение содержания мочевины к остаточному азоту. Если в норме, как уже говорилось, оно составляет около 50%, то при хронических нефритах может возрасти до 90%.
Креатинин сыворотки крови
Изменения в количестве креатинина, вырабатываемого почками, возникают только в случае далеко зашедшей патологии. В норме его концентрация практически не меняется и составляет 0,044–0,100 ммоль/л для здоровых мужчин и 0,044–0,088 ммоль/л для женщин.
Постоянное повышение уровня креатинина в крови, подобно повышенному уровню мочевины, говорит о дисфункции почек и может оцениваться как ранний признак почечной недостаточности. Также содержание креатинина повышается при патологиях, перечисленных для мочевины – за исключением простатита.
Уменьшение содержания креатинина в крови не имеет диагностического значения.
Мочевая кислота сыворотки крови
Мочевая кислота – продукт распада пуриновых оснований, входящих в состав сложных белков – нуклеопротеидов. Исследование содержания мочевой кислоты в сыворотке крови имеет важное диагностическое значение при подагре. В норме ее содержание в крови составляет для женщин 0,16–0,44 ммоль/л, у мужчин – 0,24–0,50 ммоль/л.
Гиперурикемия – повышение концентрации мочевой кислоты – выявляется при:
- подагре;
- лейкозах;
- В12-дефицитной анемии;
- некоторых острых инфекциях;
- заболеваниях печени и желчевыводящих путей;
- тяжелой форме сахарного диабета;
- экземе, псориазе и крапивнице;
- отравлении окисью углерода или метиловым спиртом.
Хотя большая часть мочевины в нашем организме образуется из эндогенных нуклеотидов, значительное их количество мы получаем с пищей. Поэтому для проведения точного анализа необходимо в течение трех дней исключить из рациона продукты с высоким содержанием пуринов (мясо, рыба, печень, почки, бобовые, грибы, шпинат).
Концентрация мочевой кислоты не используется для диагностики почечной недостаточности, т. к. не является показателем дисфункции почек.
Индикан сыворотки крови
Индикан образуется в печени при обезвреживании индола – ядовитого вещества, появляющегося в кишечнике при гниении белков. Вот почему его содержание в сыворотке крови заметно возрастает при наличии гнилостных процессов в кишечнике. Это снижает его диагностическую ценность как признака почечной недостаточности.
У здоровых людей концентрация индикана в крови равна 0,87–3,13 мкмоль/л. С учетом возможных кишечных патологий врачи условно принимают, что их следствием может быть повышение концентрации индикана до 4,7 мкмоль/л. Если анализы дают более высокие показатели, их считают признаком патологии почек.
Билирубин сыворотки крови
Билирубин образуется во всех клетках ретикулоэндотелиальной системы при распаде гемоглобина из погибших эритроцитов. Здесь вырабатывается так называемый непрямой, или свободный билирубин, циркулирующий в крови в виде комплекса с альбуминами. Он нерастворим в воде, токсичен и не проходит через почечный фильтр. Этот пигмент дает цветную реакцию со специальным реактивом только после того, как будут осаждены связанные с ним альбумины, и поэтому называется непрямым. Кровь доставляет непрямой билирубин к клеткам печени. Здесь комплекс распадается, альбумины остаются в крови, а непрямой билирубин проникает в клетки печени, где преобразуется в прямой билирубин (сразу дающий цветную реакцию) и переходит с желчью в кишечник для выведения из организма. Из кишечника часть прямого билирубина всасывается в кровоток. В итоге в норме общее содержание билирубина в крови равно 8,5–20,5 мкмоль/л, причем 70% составляет непрямой и 30% – прямой билирубин.
Гипербилирубинемия – повышение содержания билирубина в крови – сопровождается желтушной окраской слизистых оболочек и кожных покровов. Различают легкую форму желтухи – при концентрации билирубина в крови до 86 мкмоль/л, среднетяжелую (87–159 мкмоль/л) и тяжелую (свыше 160 мкмоль/л). Гипербилирубинемия наблюдается при:
- увеличении интенсивности гемолиза (разложения гемоглобина);
- поражениях паренхимы (ткани) печени;
- застойных явлениях в печени и желчных путях.
Интенсивность гемолиза возрастает при гемолитических анемиях, гемолитической болезни новорожденных, В12-дефицитной анемии, талассемии, обширных гематомах.
Паренхиматозные желтухи развиваются при инфекционном или вирусном гепатитах, циррозе и других заболеваниях печени.
Застойные явления могут быть вызваны внепеченочной обдурацией поджелудочной железы, желчнокаменной болезнью, новообразованиями, гельминтозами и медикаментозной терапией.
Показатели липидного (жирового) обмена
Липиды – это нерастворимые в воде низкомолекулярные вещества. В плазме крови они находятся в основном в форме липопротеинов, то есть сложных белков, и по свойствам близки к белкам.
Исследования обмена липидов, липопротеинов (ЛП) и холестерина (ХС) имеют не только сугубо диагностическое, но и социальное значение, так как позволяют судить о необходимости срочной профилактики сердечно-сосудистых заболеваний. Холестерин – это вид жира (липида), содержащийся в крови человека. Высокий уровень холестерина является фактором риска развития болезни сосудов сердца (ишемической болезни сердца, ИБС) – основной причины смерти и инвалидности в большинстве развитых стран.
ИБС чаще всего является причиной развития сердечной недостаточности. Термин «сердечная недостаточность» звучит непонятно и даже угрожающе, однако врачи используют его для описания ситуации, когда сердце не может обеспечить достаточный уровень кровоснабжения согласно меняющимся потребностям организма. Это может быть причиной появления определенных симптомов. Медицинская помощь – обычно это прием лекарств – способна улучшить работу сердца.
Точной статистики о числе пациентов с хронической сердечной недостаточностью в России нет, но, опираясь на имеющиеся в мире данные, можно предположить, что их не менее 3–3,5 млн человек. Это только пациенты со сниженной насосной функцией левого желудочка и явными симптомами сердечной недостаточности. По данным статистики, примерно столько же пациентов имеют симптомы хронической сердечной недостаточности при нормальной насосной функции сердца и вдвое больше – с бессимптомной дисфункцией левого желудочка. Так что речь идет о 12—14 млн больных в России – данных о том, сколько человек заболевает ежегодно, у нас вообще не публиковалось.
Как уже говорилось выше, слишком высокий уровень холестерина в крови может привести к сужению и закупорке артерий. Обычно ишемическая болезнь сердца развивается в результате сужения артерий, поставляющих кровь к сердцу. При сужении этих артерий происходит недостаточное поступление крови, или даже прекращение притока крови, к сердечной мышце. Данный процесс может развиться в любой части кровеносной системы. Если нарушается приток крови к мозгу, происходит инсульт; если же блокируются артерии, снабжающие кровью нижнюю часть тела, может развиться гангрена (почернение и отмирание кожи и мышц). Эти нарушения также могут ослабить главную артерию организма – аорту, вызывая расширение ее стенок (аневризму), что приводит к особенно тяжелым последствиям.
Процесс, вызывающий сужение просвета сосудов за счет формирования липидных отложений, и последующее разрастание соединительной ткани и отложение кальция в стенках сосудов, называется атеросклерозом. На ранней стадии процесса на стенках артерий откладываются полоски жира, содержащие холестерин. Это начинает происходить, когда человеку исполняется приблизительно 20 лет. Данный процесс не является нормальным, однако эти полоски жира не представляют опасности здоровью и могут исчезнуть. Однако они могут откладываться и дальше и тем самым вызвать необратимые изменения структуры стенок артерий, что ведет к разрастанию соединительной ткани, похожей на рубец, вокруг сгустка холестерина. Такие изменения происходят не у всех, но с возрастом это становится все более распространенной проблемой.
Данный процесс поражает относительно небольшие участки внутри артерии, и очень часто происходит выпячивание внутренней поверхности сосуда, когда образуются так называемые «бляшки». Холестериновые бляшки исчезают не так легко, как полоски жира. В результате появления бляшек может произойти сужение артерии, и как следствие некоторые части тела будут недостаточно снабжаться кислородом.
Кроме того, могут появиться и другие осложнения, например образование тромба в артерии. При этом артерия может быть полностью закупорена, и если данная область не снабжается кровью другими сосудами, то может произойти некроз тканей (инфаркт), приводящий к инфаркту миокарда, инсульту или гангрене.
Кровь для анализа на липиды берется из вены и только натощак, не раньше чем через 12—14 часов после последнего приема пищи. В противном случае жиры, поступившие с продуктами в кишечник, а оттуда – в периферическую кровь, исказят результат анализа, и скорее всего будет получена картина гиперлипемии (ГЛП) – повышенного содержания липидов.
Определяют 3 вида липидов:
- холестерин (ХС);
- триглицериды (ТГ);
- фосфолипиды.
Холестерин, ЛПНП, ЛПВП
Из перечисленной выше троицы самое важное диагностическое значение врачи придают холестерину. Холестерин является неотъемлемой частью абсолютно всех клеток организма, и синтезируется практически во всех клетках, однако основная его масса вырабатывается в печени и поступает вместе с пищей. Сам организм в сутки вырабатывает до 1 г ХС, входящего в состав клеточных мембран и ЛП и являющегося предшественником стероидных гормонов. У практически здоровых людей 2/3 ХС плазмы содержится в виде атерогенных ЛП (липопротеинов низкой плотности, ЛПНП, способствующих развитию атеросклероза), а 1/3 – в виде антиатерогенных ЛП (липопротеинов высокой плотности, ЛПВП, препятствующих развитию атеросклероза).
В норме уровень общего холестерина крови колеблется в весьма широких пределах: 3,6–6,7 ммоль/л. У мужчин содержание ХС несколько выше, чем у женщин. Рекомендуемые значения ХС крови не превышают 5,2 ммоль/л, пограничные колеблются между 5,2–6,5 ммоль/л. Значения больше 6,5 ммоль/л считаются повышенными.
На уровень холестерина в крови здорового человека могут повлиять многие факторы: возраст, физическая или умственная нагрузка и даже воздействие внешней среды.
Повышенное содержание холестерина называется гиперхолестеринемией и оценивается врачами как признак атеросклероза кровеносных сосудов или по меньшей мере как фактор риска развития атеросклероза. В России гиперхолестеринемией страдают не менее 10% населения. Правда, следует помнить и о том, что человек может страдать от атеросклероза, но иметь нормальный уровень холестерина в крови.
Гиперхолестеринемия отмечается при:
- первичных гиперлипемиях (ГЛП) – наследственно обусловленных дефектах метаболизма;
- вторичных ГЛП – ишемическая болезнь сердца (ИБС); заболевания печени; поражения почек, сопровождающиеся отеками; гипотиреоз; заболевания поджелудочной железы; сахарный диабет; ожирение; беременность; алкоголизм; прием ряда лекарств.
Гипохолестеринемия отмечается при:
- голодании;
- злокачественных новообразованиях;
- болезнях печени;
- заболеваниях легких (туберкулез, неспецифические пневмонии, саркоидоз органов дыхания);
- гипертиреозе;
- анемии;
- поражениях центральной нервной системы (ЦНС);
- лихорадочных состояниях;
- сыпном тифе;
- обширных ожогах;
- гнойно-воспалительных процессах в мягких тканях;
- сепсисе;
- талассемии.
Использование теста на общий ХС целесообразно для исследования пациентов с ранними факторами риска атеросклероза, с заболеваниями сосудов и сердца, гипертонией, ожирением и заядлых курильщиков.
Уровень содержания в крови ХС и ТГ являются наиболее важными показателями липидного обмена.
Триглицериды
Триглицериды (ТГ), или нейтральные жиры, – это производные глицерина и высших жирных кислот. Триглицериды – главный источник энергии для клеток. Триглицериды поступают в наш организм с пищей, синтезируются в жировой ткани, печени и кишечнике. Уровень триглицеридов в крови зависит от возраста человека. Анализ триглицеридов используют в диагностике атеросклероза и многих других заболеваний.
Таблица 6
Норма триглицеридов
Если ТГ выше нормы, то у врача есть все основания подозревать:
- ишемическую болезнь сердца, инфаркт миокарда, гипертоническую болезнь;
- атеросклероз;
- тромбоз сосудов мозга;
- хроническую почечную недостаточность;
- ожирение;
- вирусный гепатит, цирроз печени;
- подагру;
- талассемию;
- нарушение толерантности к глюкозе;
- синдром Дауна;
- заболевания печени – гепатит, цирроз;
- невротическую анорексию;
- гиперкальцемию;
- алкоголизм;
- сахарный диабет;
- гипотиреоз;
- острый и хронический панкреатит.
ТГ повышены при беременности, при приеме пероральных противозачаточных средств, препаратов половых гормонов.
Триглицериды ниже нормы наблюдаются в таких состояниях:
- хронические заболевания легких;
- инфаркт мозга;
- гипертиреоз;
- поражение паренхимы (ткани почки);
- миастения;
- травмы, ожоги;
- недостаточное питание;
- прием витамина С.
Активность ферментов сыворотки крови
Ферменты (или энзимы) – это белки специфической природы, которые синтезируются в клетках, катализируют биохимические реакции (т. е. увеличивают их скорость), происходящие в нашем организме, но сами при этом остаются неизменными. Можно без преувеличения сказать, что ни одна реакция в живых организмах не протекает без участия ферментов. Человек научился использовать ферментативные процессы еще в древности – например, в хлебопечении или виноделии.
Как и прочие белки, по молекулярному составу ферменты делятся на простые и сложные, причем сложные содержат белковый компонент (апофермент, или апоэнзим) и небелковый (кофермент, или коэнзим). Чаще всего коэнзимом является металл, витамин или его производная. По размерам коэнзим во много раз меньше, чем апоэнзим. Функциональная активность фермента определяется кофигурацией его молекулы, создающей специфическое взаимное расположение аминокислот. Это зависит от ряда факторов: вида и концентрации субстрата (объекта, на который воздействует фермент), температуры, рН среды (для каждой реакции есть свои оптимальные температура и рН), наличия и отсутствия ингибиторов (веществ, подавляющих работу ферментов). Важнейшей особенностью ферментов является их уникальная специфичность, то есть возможность взаимодействовать только с одним субстратом или с группой веществ, сходных по своему строению.
Изменение активности одних и тех же ферментов происходит при самых различных заболеваниях и, следовательно, не становится специфичным для какой-либо патологии.
Поэтому определение активности ферментов имеет диагностическое значение только при сопоставлении с изменениями других показателей и клинической картиной заболевания в целом.
На сегодняшний день подробно описано около 1000 энзимов, и из них более 50 нашли использование в клинической лабораторной диагностике.
В нашем теле у каждого органа есть свой специфический набор ферментов. Определяя их активность, можно судить и о том, как работает сам орган. Правда, в основном эта работа происходит во внутриклеточной среде, но и анализ внеклеточных составляющих (в данном случае плазмы или сыворотки крови) позволяет судить о процессах, идущих в клетках, и функциональном состоянии органов и тканей.
Определение активности ферментов в сыворотке или плазме крови стало одним из рутинных лабораторных анализов в 1954 г., когда стало ясно диагностическое значение повышенной активности аспартатаминотрансферазы (АСТ, содержится в большом количестве в миокарде и резко повышает активность при инфаркте миокарда) и аланинаминотрансферазы (АЛТ, содержится во всех паренхиматозных органах. Его активность в плазме напрямую связана с патологическими процессами в ткани печени).
Дальнейшие исследования показали, что для каждого фермента в процессе заболевания есть свое время появления в сыворотке крови, нарастание активности вплоть до определенного пика и последующая инактивация. Это связано с тем, что патологический процесс вызывает разрушение клеток, чье содержимое (в том числе и ферменты) в итоге оказывается в крови.
Так называемая длительность периода полураспада ферментов является главным фактором, определяющим период времени, когда активность фермента повышена в плазме или сыворотке крови.
Активность ферментов измеряется в моль/(с?л); мкмоль/(с?л), нмоль(с?л).
Международная единица (МЕ, UE) измеряется в мкмоль/(мин?л) и равна 16,67 нмоль/(с?л).
Относительно новая единица каталитической активности – нкатал/л – равна нмоль/(с?л).
Аспартатаминотрансфераза (АСТ, АсАТ)
АСТ (АсАТ), или аспартатаминотрансфераза, – клеточный фермент, участвующий в обмене аминокислот. АСТ содержится в тканях сердца, печени, почек, нервной ткани, скелетной мускулатуры и других органов. Благодаря высокому содержанию в тканях этих органов, анализ крови АСТ – необходимый метод диагностики заболеваний миокарда, печени и различных нарушений мускулатуры.
Норма АСТ в крови для женщин – до 31 Ед/л, для мужчин норма АсАТ – до 41 Ед/л.
Анализ крови может показать повышение концентрации АСТ при:
- инфаркте миокарда;
- вирусном, токсическом, алкогольном гепатите;
- стенокардии;
- остром панкреатите;
- раке печени;
- остром ревмокардите;
- тяжелой физической нагрузке;
- сердечной недостаточности.
АСТ повышен при травмах скелетных мышц, ожогах, тепловом ударе и вследствие кардиохирургических операций.
Анализ крови АсАТ показывает понижение уровня АсАТ в крови вследствие тяжелых заболеваний, разрыва печени и при дефиците витамина В6.
Аланинаминотрансфераза (АлАТ, АЛТ)
АлАТ (АЛТ), или аланинаминотрансфераза, – фермент печени, участвующий в обмене аминокислот. Наряду с АСТ в большом количестве содержится АЛТ в печени, почках, в сердечной мышце, скелетной мускулатуре. При разрушении клеток этих органов, вызванных различными патологическими процессами, происходит выделение АЛТ в кровь человека, и анализ покажет высокий АлАТ в крови. В здоровом организме содержание показателя АЛТ в крови незначительно.
Норма АЛТ (норма АлАТ) для женщин – до 31 Ед/л, для мужчин норма АлАТ – до 41 Ед/л.
Повышение АЛТ – признак таких серьезных заболеваний, как:
- вирусный гепатит;
- токсическое поражение печени;
- цирроз печени;
- хронический алкоголизм;
- рак печени;
- токсическое действие на печень лекарств (антибиотиков и др.);
- желтуха;
- сердечная недостаточность;
- миокардит;
- панкреатит;
- инфаркт миокарда;
- шок;
- ожоги;
- травма и некроз скелетных мышц;
- обширные инфаркты;
- сердечная недостаточность.
Биохимический анализ крови на АЛТ покажет снижение уровня АлАТ при тяжелых заболеваниях печени – некроз, цирроз (при уменьшении количества клеток, синтезирующих АЛТ). Результаты анализа крови АлАТ покажет низкое содержание аланинаминотрансферазы при дефиците витамина В6.
Щелочная фосфатаза
Щелочная фосфатаза участвует в обмене фосфорной кислоты, отщепляя ее от органических соединений и способствуя транспорту фосфора в организме. Самый высокий уровень содержания щелочной фосфатазы – в костной ткани, слизистой оболочки кишечника, в плаценте и молочной железе во время лактации. Норма щелочной фосфатазы в крови у женщин – до 240 Ед/л, у мужчин – до 270 Ед/л. Щелочная фосфатаза влияет на рост костей, поэтому у детей ее содержание выше, чем у взрослых.
Биохимический анализ крови на щелочную фосфатазу проводят для диагностики заболеваний костной системы, печени, желчевыводящих путей и почек. Повышенная щелочная фосфатаза в крови может стать поводом для врача поставить следующий диагноз:
- заболевание костной ткани, в том числе опухоли костной ткани, саркома, метастазы рака в кости;
- гиперпаратиреоз;
- миеломная болезнь;
- лимфогранулематоз с поражением костей;
- инфекционный мононуклеоз;
- рахит;
- заболевания печени (цирроз, рак, инфекционный гепатит, туберкулез);
- опухоли желчевыводящих путей;
- инфаркт легкого, инфаркт почки.
Повышение щелочной фосфатазы происходит в последнем триместре беременности, после менопаузы, при недостатке кальция и фосфатов в пище, от передозировки витамина С и как следствие приема некоторых лекарственных препаратов (оральных контрацептивов, содержащих эстроген и прогестерон, антибиотиков и других).
Уровень щелочной фосфатазы снижен при гипотиреозе, нарушениях роста кости, недостатке в пище цинка, магния, витамина В12 или С (цинга), анемии (малокровии). Прием медицинских препаратов также может вызвать понижение щелочной фосфатазы в крови. Во время беременности снижение активности щелочной фосфатазы происходит при недостаточности развития плаценты.
Холинэстераза (ХЭ)
Холинэстераза (ХЭ) – фермент, образующийся в печени. Холинэстераза содержится в нервной ткани, скелетных мышцах. Так называемая сывороточная холинэстераза присутствует в печени, поджелудочной железе, выделяется печенью в кровь. Определение холинэстеразы в медицине используется для диагностики возможного отравления инсектицидами и оценки функции печени. Биохимический анализ крови на холинэстеразу используется для оценки риска осложнений при хирургических вмешательствах. Норма холинэстеразы – 5300–12900 Ед/л. Содержание фермента холинэстеразы в крови человека начинает резко снижаться при тяжелых хронических заболеваниях печени, особенно при циррозе.
Низкая холинэстераза в крови – признак таких заболеваний, как:
- заболевания печени (цирроз, гепатит, метастатический рак печени);
- острое отравление инсектицидами;
- инфаркт миокарда;
- онкологические заболевания.
Понижение уровня холинэстеразы происходит на позднем сроке беременности, после хирургического вмешательства и при применении некоторых медицинских препаратов (оральных контрацептивов, анаболических стероидов, глюкокортикоидов).
Повышенная холинэстераза – симптом следующих заболеваний:
- артериальная гипертония;
- нефроз;
- рак молочной железы;
- ожирение;
- алкоголизм;
- сахарный диабет;
- столбняк;
- маниакально-депрессивный психоз;
- депрессивный невроз.
Повышение уровня холинэстеразы происходит на начальном этапе беременности.
Альфа-амилаза (диастаза)
Альфа-амилаза (диастаза) образуется в слюнных железах и поджелудочной железе. Также в поджелудочной железе образуется панкреатическая амилаза – фермент, участвующий в расщеплении крахмала и других углеводов в просвете двенадцатиперстной кишки. Амилаза, расщепляя крахмал и другие углеводы, обеспечивает переваривание углеводов пищи. Из организма амилазу выводят почки вместе с мочой. Определение активности амилазы используется в диагностике заболеваний поджелудочной железы, слюнных желез, для выяснения причин боли в животе. Норма альфа-амилазы в крови (норма диастазы) – 28–100 Ед/л. Нормы амилазы панкреатической – от 0 до 50 Ед/л.
Повышенная альфа-амилаза – симптом следующих заболеваний:
- острый, хронический панкреатит (воспаление поджелудочной железы);
- киста поджелудочной железы, камень, опухоль в протоке поджелудочной железы;
- эпидемический паротит;
- острый перитонит;
- сахарный диабет;
- заболевания желчных путей (холецистит);
- почечная недостаточность.
Уровень амилазы повышается при травме живота и как следствие прерывания беременности. Уровень панкреатической амилазы в крови возрастает в 10 раз и более выше нормы при остром панкреатите или при обострении хронического панкреатита, эпидемическом паротите. Резкое повышение уровня амилазы панкреатической может быть связано с воспалением поджелудочной железы, вследствие закупорки протока поджелудочной железы кистой, опухолью, камнем, спайками. Биохимический анализ крови амилазы покажет нулевые значения содержания амилазы при недостаточности функции поджелудочной железы, остром и хроническом гепатите. Снижение нормального уровня амилазы крови происходит при токсикозе у беременных.
Для определения фермента амилазы также используется анализ мочи.
Креатинкиназа
Креатинкиназа (креатинфосфокиназа) – фермент, содержащийся в скелетных мышцах, реже – в гладких мышцах (матке, ЖКТ) и головном мозге. Креатинкиназа обеспечивает энергией клетки мышц. В сердечной мышце – миокарде – содержится особый вид креатинкиназы – креатинкиназа МВ. При повреждении мышц наблюдается выход фермента из клеток – повышение активности креатинкиназы в крови. Поэтому определение креатинфосфокиназы и креатинкиназы МВ в крови широко применяется в ранней диагностике инфаркта миокарда. Уже через 2–4 часа после острого приступа уровень креатинкиназы МВ в крови значительно повышается. Анализ креатинкиназы МВ позволяет со 100%-ной точностью диагностировать инфаркт миокарда.
Таблица 7
Нормы креатинкиназы
Нормы креатинкиназы МВ в крови – 0–24 Ед/л.
Повышение креатинкиназы происходит при следующих заболеваниях:
- инфаркт миокарда;
- миокардит;
- миокардиодистрофия;
- сердечная недостаточность;
- тахикардия;
- столбняк;
- гипотиреоз;
- алкогольный делирий (белая горячка);
- заболевания центральной-нервной системы (шизофрения, маниакально-депрессивный психоз, эпилепсия, черепно-мозговые травмы);
- злокачественные опухоли (рак мочевого пузыря, молочной железы, кишечника, легкого, матки, простаты, печени).
Повышение креатинфосфокиназы в крови может быть следствием хирургических операций и диагностических процедур на сердце, приема некоторых лекарственных средств (кортикостероидов, барбитуратов, наркотических средств), после тяжелой физической нагрузки. Повышение креатинкиназы также происходит при беременности. Понижение уровня креатинкиназы происходит при снижении мышечной массы и малоподвижном образе жизни.
Липаза
Липаза – фермент, синтезируемый многими органами и тканями для расщепления нейтральных жиров – триглицеридов. Особое значение в диагностике имеет липаза, вырабатываемая поджелудочной железой – панкреатическая липаза. В активной форме липаза выделяется в двенадцатиперстную кишку и тонкий кишечник, где расщепляет жиры пищи – триглицериды на глицерин и высшие жирные кислоты. При заболеваниях поджелудочной железы активность липазы значительно повышается, и липаза в большом количестве начинает выделяться в кровь. Норма липазы для взрослых – 0–190 Ед/мл. При остром панкреатите уровень липазы в крови увеличивается через несколько часов после острого приступа до 200 раз.
Определение липазы составляет основу диагностики панкреатита одновременно с анализом уровня альфа-амилазы в крови. Повышение уровня липазы может означать следующие заболевания:
- панкреатит, опухоли, кисты поджелудочной железы;
- хронические заболевания желчного пузыря, желчная колика;
- инфаркт, непроходимость кишечника, перитонит;
- костные переломы, ранения мягких тканей;
- рак молочной железы;
- почечная недостаточность;
- заболевания, сопровождающиеся нарушением обмена веществ, а особенно липидов – ожирение, сахарный диабет, подагра;
- эпидемический паротит.
Повышение липазы в крови может быть следствием приема некоторых медицинских препаратов (барбитуратов и других). Понижение уровня липазы может происходить при онкологических заболеваниях, кроме рака поджелудочной железы и при неправильном питании (избытке триглицеридов).
Гамма-глутамилтранспептидаза (ГГТ, гамма-ГТ)
Гамма-глутамилтранспептидаза – фермент, участвующий в обмене аминокислот. Основное содержание ГГТ – в печени, почках и поджелудочной железе. В крови здорового человека содержание гамма-ГТ незначительно. Для женщин норма ГГТ – до 32 Ед/л, для мужчин – до 49 Ед/л. У новорожденных норма гаммы ГТ в 2–4 раза выше, чем у взрослых. Анализ гамма-ГТ применяется в диагностике заболеваний печени и других органов желудочно-кишечного тракта. Повышение ГГТ происходит при таких заболеваниях, как:
- камни в желчном пузыре;
- острый вирусный и хронический гепатит;
- токсическое поражение печени;
- острый и хронический панкреатит;
- алкоголизм;
- заболевания поджелудочной железы (панкреатит, сахарный диабет);
- гипертиреоз (гиперфункция щитовидной железы);
- обострение хронического гломерулонефрита и пиелонефрита;
- рак поджелудочной железы;
- рак простаты;
- рак печени.
Повышение ГГТ может быть связано с приемом некоторых медицинских препаратов, эстрогенов, оральных контрацептивов.
Альдолаза (фруктозо-1,6-дифосфатальдолаза, ФДФ-А)
Фермент альдолаза играет важную роль в нашем энергетическом обмене, т. к. участвует в расшеплении молекул фосфорилированной гексозы. Его можно обнаружить во всех тканях человека, однако основное количество находится в скелетной мускулатуре, сердечной мышце и печени.
В норме у взрослого человека активность фермента в плазме крови составляет меньше 3,1 U/l, или 3–8 усл. ед.
Увеличение активности фермента наблюдается при:
- инфаркте миокарда;
- травме мышечной ткани;
- заболеваниях печени: остром (вирусном, токсическом) гепатите, отравлениях гепатотропными («печеночными» ядами, хроническом воспалительном процессе в печени;
- панкреатите;
- злокачественных новообразованиях;
- воспалении, деструкции (распаде) мышц;
- гемолитической анемии;
- инфекционном мононуклеозе;
- тяжелой пневмонии;
- шизофрении;
- большой физической нагрузке.
Сорбитолдегидрогеназа (СДГ)
Сорбитолдегидрогеназа (СДГ) – органоспецифичный фермент, который содержится в клетках печени, и поэтому повышение его активности в плазме можно считать признаком поражения печени.
В норме его ориентировочная активность составляет 1–2 ЕД/л.
Повышение активности СДГ наблюдается при:
- остром вирусном гепатите (активность СДГ возрастает в дожелтушном периоде, предшествуя повышение в сыворотке крови уровня билирубина и активности тансаминаз);
- обострении хронического гепатита;
- печеночной коме;
- обтурационной желтухе.
Простатическая кислая фосфатаза (КФ)
Простатическая кислая фосфатаза локализуется в основном в клетках эпителия предстательной железы.
Показатели нормы активности фермента в сыворотке крови – менее 4,00 U/l.
Увеличение активности пристатической кислой фосфатазы отмечается при:
- раке предстательной железы (особенно, но не всегда при метастазах);
- доброкачественной гипертрофии простаты;
- простатите;
- инфаркте предстательной железы;
- после манипуляций на простате и катетеризации;
- болезни Гоше.
Иммунохимические методы высоко специфичны для простатической кислой фосфатазы; однако, поскольку этот фермент не повышен на ранних стадиях заболевания предстательной железы, тест не рекомендуется для использования при скрининге. Он может быть применен для слежения за течением болезни.
Глюкоза-6-фосфатдегидрогеназа (Г-6-ФДГ)
Глюкоза-6-фосфатдегидрогеназа содержится главным образом в эритроцитах и демонстрирует самую высокую активность в молодых клетках. Врожденный дефект Г-6-ФДГ относится к наиболее распространенным энзимопатиям и может проявляться гемолитическими кризисами.
Показатели нормы активности фермента составляют 120—240 мЕД/млрд эритроцитов. В сыворотке активности не выявляется, а в эритроцитах она составляет 131?13 mU/109 клеток.
Дефицит фермента в эритроцитах вызывает гемолитическую анемию после приема противомалярийных препаратов, некоторых сульфаниламидов и витамина С.
Уроканиназа
Уроканиназа содержится главным образом в печени, и в норме ее активность в сыворотке крови отсутствует.
Повышение активности наблюдается при:
- циррозе печени;
- хронических гепатитах;
- токсических гепатитах.
При вирусных или токсических гепатитах активность фермента может достигать значений 5–13 нмоль/(с?л).
Содержание витаминов в сыворотке крови
Компоненты пищи, называемые витаминами, – это вещества, которые необходимы в небольших количествах для нормальной жизнедеятельности организма, но либо не вырабатываются в нем, либо вырабатываются в недостаточном количестве. Энергетическая ценность витаминов невелика. Они выполняют очень специфические функции в работе клеток. Часто они входят в состав ферментов или оказывают действие на работу той или иной системы (например, витамин С на соединительную ткань).
Некоторые витамины не содержатся в пище в готовом виде: например, витамин К синтезируется нормальной кишечной флорой, а некоторые другие витамины образуются в организме из предшественников (например, витамин А – из каротина), или так называемых провитаминов. Витамины бывают водорастворимые (витамины группы В, биотин, витамины группы фолиевой кислоты, никотиновая кислота и никотинамид, пантотеновая кислота и витамин С) и жирорастворимые (витамины А, D, Е и К), для усвоения которых необходимо употребление продуктов, содержащих жиры.
Витамин В12
Витамин В12 (или цианокобаламин, кобаламин) – уникальный витамин в организме человека, содержащий незаменимые минеральные элементы. Большое количество витамина B12 необходимо селезенке и почкам, несколько меньше поглощается мышцами. Кроме того, витамин В12 содержится в молоке матери. Характеристика витамина В12:
- витамин B12 необходим для образования и созревания эритроцитов;
- витамин B12 влияет на нервную систему, поддерживая ее в здоровом состоянии, снижает раздражительность;
- витамин В12 предотвращает появление анемии;
- цианокобаламин участвует в белковом, жировом и углеводном обмене;
- кобаламин участвует в процессе усвоения, транспорта и распада фолиевой кислоты;
- витамин B12 помогает увеличивать энергию;
- витамин В12 способствует росту и улучшению аппетита;
- витамин B12 помогает улучшить концентрацию, память и чувство равновесия.
В организме не происходит синтез витамина В12, его мы получаем с продуктами питания – источниками витамина В12. Содержат кобаламин продукты животного происхождения: печень, говядина, рыба, свинина, яйца, молоко, сыр, почки. Благополучному усвоению витамина В12 мешает одновременное употребление кислот, щелочей, воды, алкоголя, эстрогенов, снотворных таблеток. Для благополучного усвоения витамина B12 необходимо достаточное количество кальция, с которым В12 должен вступить во взаимодействие во время принятия пищи для того, чтобы он мог принести пользу для организма. Распад витамина B12 происходит очень медленно, из организма цианокобаламин выводится с желчью. При дефиците В12 в течение около 5–6 лет развивается В12-дефицитная анемия.
Норма витамина В12: 180—900 пг/мл.
Рекомендуемая суточная доза витамина В12 для взрослых –3 мкг.
Дефицит витамина B12 приводит к серьезным, опасным для здоровья последствиям – развивается B12-дефицитная анемия. Особенно подвержены этой разновидности анемии вегетарианцы и любители ограничительных диет, исключившие из своего рациона яйца и молочные продукты. При недостатке цианокобаламина происходят изменения в клетках костного мозга, полости рта, языка и желудочно-кишечного тракта, что ведет к нарушению кроветворения, появлению симптомов неврологических расстройств (психические расстройства, полиневриты, поражение спинного мозга). В12-дефицитная анемия может привести к заболеваниям печени, почек, заболеваниям крови, онкологическим заболеваниям, лейкозам. Дефицит витамина В12 в молоке матери приводит к мегалобластной анемии у ребенка. Недостаток витамина В12 – повод для врача поставить следующий диагноз:
- нарушение всасывания, распада и транспорта витамина В12;
- алкоголизм;
- резекция желудка, резекция тонкого кишечника;
- хронические воспалительные заболевания и аномалии тонкого кишечника, атрофический гастрит;
- болезнь Альцгеймера;
- дефицит фолиевой кислоты.
Избыток витамина B12 наблюдается при таких заболеваниях:
- заболевания печени (острый и хронический гепатит, цирроз, печеночная кома);
- острый лейкоз;
- метастазы злокачественных опухолей в печень;
- хроническая почечная недостаточность.
Фолиевая кислота
Фолиевая кислота (Folic Acid, фолацин) – водорастворимый витамин группы В. Для чего нужна фолиевая кислота?
- Фолиевая кислота необходима для нормального кроветворения; вместе с витамином В12 фолиевая кислота необходима для деления клеток, что особенно важно для тканей, которые активно делятся и дифференцируются (например, во время внутриутробного развития);
- фолацин способствует усвоению, транспорту и распаду белков, способствует соединению белковой группы и гема в гемоглобине и миоглобине;
- стимулирует пластические и регенераторные процессы во всех органах и тканях;
- фолиевая кислота необходима для усвоения сахара и аминокислот;
- важна для образования нуклеиновых кислот (РНК и ДНК), участвующих в передаче наследственных признаков;
- фолацин предупреждает развитие атеросклероза, обладает анальгетическим действием;
- улучшает выделение молока;
- обеспечивает защиту от кишечных паразитов и пищевых отравлений;
- фолиевая кислота обеспечивает здоровый вид кожи, улучшает аппетит;
- действует как профилактическое средство от язвенного стоматита.
Норма содержания фолиевой кислоты в сыворотке крови – 3–17 нг/мл.
Рекомендуемая дневная норма потребления (РНП) – суточная доза фолиевой кислоты для взрослых – 400 мкг. Во время беременности суточная норма фолиевой кислоты у женщин удваивается до 800 мкг. Источник фолиевой кислоты – микрофлора кишечника. Фолиевая кислота содержится в большом количестве в листьях зеленых растений. Отсюда этот витамин, фолиевая кислота, и получил свое название от латинского слова «фолиум» – лист. Продукты с высоким содержанием фолиевой кислоты: темно-зеленые овощи с листьями (шпинат, салат-латук, спаржа), морковь, дрожжи, печень, яичный желток, сыр, дыня, абрикосы, тыква, авокадо, бобы, цельная пшеничная и темная ржаная мука. Прием фолиевой кислоты с продуктами может быть нейтрализован при одновременном приеме эстрогенов и при тепловой обработке (варке) продуктов.
Концентрация фолиевой кислоты в сыворотке крови, ее уровень, зависит от поступления фолиевой кислоты с пищей, употребления продуктов, содержащих фолиевую кислоту. Запасы фолиевой кислоты имеются и в самом в организме – в печени, эритроцитах и лейкоцитах. Но количество фолиевой кислоты в этих органах невелико. Вследствие этого дефицит фолиевой кислоты может возникнуть уже через месяц после прекращения поступления фолиевой кислоты с продуктами питания. Уже через 4 месяца недостаток фолиевой кислоты приводит к развитию В12-фолиеводефицитной анемии или мегалобластной анемии: развивается нарушение образования эритроцитов в костном мозге (так называемых мегалобластов). Это нарушение приводит к выходу в кровь гигантских незрелых эритроцитов и снижению гемоглобина в крови.
Кроме того, и для женщин, и для мужчин фолиевая кислота в недостаточном содержании – признак следующих серьезных нарушений:
- недостаточное питание;
- нарушение всасывания фолиевой кислоты (резекция желудка и кишечника);
- дефицит витамина В12;
- алкоголизм;
- лихорадка;
- гемолитическая анемия;
- злокачественные опухоли;
- гипертиреоз у детей;
- заболевания печени;
- анорексия.
Уровень фолиевой кислоты в сыворотке крови снижают медицинские препараты (аспирин, бисептол, противосудорожные средства, эстрогены, контрацептивы и др.). Повышение фолиевой кислоты происходит при вегетарианской диете, заболеваниях тонкого кишечника.
Беременность и фолиевая кислота. Дефицит фолиевой кислоты – самый распространенный гиповитаминоз среди беременных, новорожденных и детей раннего возраста. Причем недостаток фолиевой кислоты передается от матери к плоду или новорожденному ребенку вследствие недостаточного содержания фолиевой кислоты при беременности в организме матери и нехватки фолиевой кислоты в молоке.
Недостаточное поступление фолиевой кислоты во время беременности в организме матери может привести различным негативным последствиям:
- выкидыш;
- частичная или полная отслойка плаценты;
- спонтанный аборт и рождение мертвого ребенка;
- врожденные пороки у плода;
- задержка умственного развития.
При недостатке фолиевой кислоты беременные сами женщины также расплачиваются различными недомоганиями:
- токсикоз;
- депрессия;
- боли в ногах;
- анемия.
Для успешного протекания беременности, сохранения здоровья матери и рождения здорового ребенка врачи назначают прием фолиевой кислоты в таблетках при планировании беременности и в течение срока вынашивания. Но принимать фолиевую кислоту нужно строго в соответствии дозировке, назначенной вам врачом. Передозировка фолиевой кислоты не менее опасна для здоровья, чем недостаток.
Показатели водно-солевого обмена
На долю воды приходится 60% массы тела у мужчин и 52% – у женщин. Водные растворы являются той средой, в которой протекают все без исключения биохимические реакции – как внутри клеток, так и во внеклеточном пространстве. Даже нерастворимые в воде вещества транспортируются в этой среде, вступая в комплексы с водорастворимыми белками. Биохимические растворы являются электролитами, в которых в виде ионов присутствуют как органические, так и неорганические вещества.
Нарушение концентрации ионов, в первую очередь натрия, калия, кальция, хлоридов и бикарбонатов, может привести к различным расстройствам обмена веществ, а в крайнем случае – даже к смерти.
Натрий (Na+)
Натрий (Na+) – основной катион внеклеточного пространства. Вместе с анионами хлора он обусловливает осмотическую активность плазмы крови и других биологических жидкостей.
Нормальная концентрация Na+ в крови здоровых людей колеблется в пределах 135—150 ммоль/л.
Повышение концентрации в крови Na+ (гипернатриемия) наблюдается при:
- ограничении приема воды;
- несахарном диабете;
- продолжительной рвоте и поносе без возмещения жидкости; недостатке калия;
- хронических заболеваниях почек;
- обильной потере воды через кожу, легкие.
Понижение концентрации в крови Na+ (гипонатриемия) наблюдается при:
- длительном применении диуретиков;
- частых поносах и рвоте;
- обширных ожогах;
- заболеваниях почек с потерей натрия;
- сахарном диабете;
- недостаточности коры надпочечников.
Калий (К+)
Калий (К+) – основной внутриклеточный катион, участвующий в поддержании осмотического давления, кислотно-основного равновесия, некоторых функций клеток, особенно нервных и мышечных. Концентрация К+ существенно влияет на работу сердечной мышцы.
Нормальная концентрация К+ в плазме – 3,60–5,40 ммоль/л. Снижение ее до уровня менее 3,50 ммоль/л (гипокалиемия) приводит к тяжелым нарушениям в организме: слабости мышц, вялым параличам, прекращению перистальтики кишечника, вздутию живота. Поддержание в норме концентрации К+ необходимо для обеспечения способности к возбудимости нервных и мышечных клеток.
Гипокалиемия наблюдается при:
- недостаточном поступлении с пищей;
- увеличении потерь при поносе, рвоте, применении калийистощающих мочегонных и стероидных препаратов;
- некоторых гормональных нарушениях;
- внутривенном введении больших количеств жидкости, не содержащей К+.
Гиперкалиемия наблюдается при:
- выраженной почечной недостаточности;
- ацидозе;
- неконтролируемом введении.
Кальций (Са2+)
Кальций (Са2+) – основной компонент костной ткани и зубов, участвует в свертывании крови, сокращении мышц, деятельности некоторых эндокринных желез. Всасывание и выведение кальция контролируют гормоны и активные метаболиты витамина D.
Около 50% кальция плазмы находится в ионизированном виде, 45% связано я альбумином и около 5% – с комплексирующими ионами (фосфат, цитрат). Наибольшей физиологической активностью обладает ионизированный кальций.
В норме концентрация общего кальция в сыворотке (плазме) крови составляет 2,00–2,80 ммоль/л, ионизированного – 1,10–1,40 ммоль/л.
Увеличение концентрации кальция в крови (гиперкальциемия) наблюдается при:
- избыточном в ведении в организм ребенка витамина D;
- распаде клеток тканей при размягчении костей, обусловленном злокачественными образованиями;
- первичном гиперпаратиреоидизме;
- гипертиреозе;
- использовании заместительной гормонотерапии (ЗГТ); передозировке витаминов;
- хроническом энтерите.
Гипокальциемия наблюдается при:
- заболеваниях почек;
- снижении секреции в кровь гормона паращитовидной железы;
- уменьшении содержания альбумина в плазме;
- поносе;
- дефиците витамина D;
- рахите и спазмофилии;
- нарушении всасывания кальция в кишечнике;
- хронической недостаточности почек;
- циррозе печени;
- гиперплазии надпочечников;
- под влиянием протипоэпилептической терапии.
Фосфор и фосфоросодержащие вещества
Фосфор – элемент, метаболизм которого напрямую связан с обменом кальция. Встречается главным образом в виде аниона РО43–. Принимает участие в обеспечении организма энергией. 80—85% неорганического фосфора входит в состав скелета, остальное количество распределено между тканями и жидкостями организма. Фосфор принимает участие в образовании нуклеиновых кислот, нуклеотидов, фосфолипидов и других соединений. Концентрация неорганического фосфора ниже 0,30 ммоль/л ведет к нарушению энергетического обмена клеток.
В норме содержание неорганического фосфора в крови составляет 1–2 ммоль/л.
Гиперфосфатемия отмечается при:
- почечной недостаточности;
- передозировке витамина D;
- недостаточности паращитовидных желез;
- всех заболеваниях, связанных с кислородной недостаточностью.
Гипофосфатемия отмечается при:
- дефиците витамина D;
- нарушениях всасывания в кишечнике;
- рахите;
- гиперфункции паращитовидных желез.
Магний (Mg2+)
Магний (Mg2+) – второй по концентрации после калия внутриклеточный катион, входящий в состав ряда ферментов. 1/3 от всего количества магния, содержащегося в организме, находится в костях, зубах и мышцах. Магний поступает в организм с растительной пищей (хлорофилл) и мясными продуктами.
Нормальная концентрация магния в плазме – 0,65–1,10 ммоль/л.
Гипомагниемия наблюдается при:
- больших потерях воды;
- нарушениях всасывания в кишечнике;
- хроническом алкоголизме;
- беременности;
- хронической сердечной недостаточности;
- хроническом воспалении поджелудочной железы.
Недостаток магния приводит к нарушениям сердечной деятельности, повышенной возбудимости и судорогам.
Гипермагниемия наблюдается при:
- хронической почечной недостаточности;
- гипофункции щитовидной железы;
- распаде тканей.
Избыточное содержание магния может привести к вялости, сонливости, блокаде нервно-мышечной передачи.
Хлорид-ионы (Cl–)
Хлорид-ионы (Cl–) – главные внеклеточные анионы. Это основной вид анионов плазмы крови, уравновешивающий влияние катионов (в первую очередь натрия) во внеклеточной жидкости. Его содержание в крови зависит от уровня содержания карбонатов (ионов угольной кислоты): если повышается содержание карбоната, то уменьшается количество ионов хлора.
Показатели нормы содержания хлорид-ионов в плазме крови составляют 95,00–110,00 ммоль/л.
Гипохлоремия наблюдается при:
- избыточном потооделении;
- рвоте;
- респираторном и метаболическом ацидозе;
- применении мочегонных препаратов;
- появлении отеков.
Гиперхлоремия считается признаком обезвоживания и наблюдается при:
- недостаточном поступлении жидкости;
- нарушении мочеотделения при заболеваниях почек или закупорке мочеточников;
- несахарном диабете;
- респираторном алкалозе;
- артериальной гипертензии;
- недостаточности коры надпочечников.
Железо
Железо относится к микроэлементам (т. е. к тем элементам, содержание которых в организме находится в пределах от нескольких миллиграммов до нескольких нанограммов). Несмотря на относительно малое количество, они заметно влияют на биохимические процессы и функции организма, т. к. входят в состав ферментов, комплексы белков и нуклеиновых кислот, являются катализаторами многих процессов.
Железо – постоянная составная часть гема в гемоглобине и окислительно-восстановительных ферментов в митохондриях клеток.
Лабораторными анализами определяется плазменное железо, которое в основном связано с тансферрином, ферртином и внеэритроцитарным гемоглобином.
В норме концентрация сывороточного железа у мужчин равна 14,30—25,10 мкмоль/л, у женщин – 10,70—21,50 мкмоль/л.
Снижение концентрации сывороточного железа (гипосидеремия) наблюдается при:
- железодефицитной анемии;
- острых инфекциях;
- гнойных заболеваниях;
- сепсисе;
- острых и хронических кровопотерях;
- беременности;
- нарушении всасывания железа в желудочно-кишечном тракте;
- дефиците витамина С.
Гиперсидеремия наблюдается при:
- усиленном гемолизе эритроцитов;
- некоторых видах малокровия (перницитозная анемия, талассемия);
- приеме препаратов железа;
- вирусном гепатите.
Показатели углеводного обмена
Глюкоза – основной представитель углеводов. Она является важнейшим энергетическим материалом и обеспечивает протекание в организме многих метаболических процессов. Уровень глюкозы в крови контролируется как нейроэндокринной системой, так и паренхиматозными органами (печенью, почками и др.).
Возможно, врач недавно огорчил вас неприятной новостью о том, что вы страдаете сахарным диабетом или что у вас повышен риск заболеть этой болезнью. Естественно, вы встревожены, вас начинает мучить страх и сразу возникают вопросы – как повлияет диабет на вашу жизнь? Придется ли вам до конца своих дней есть безвкусную, лишенную сахара пищу? Придется ли вам ежедневно делать себе инъекции инсулина? Грозит ли вам неминуемая ампутация? Убьет ли вас диабет?
Для большинства больных, страдающих сахарным диабетом, на все эти вопросы можно дать отрицательный ответ. Ученые разработали множество способов ранней диагностики сахарного диабета и способов держать заболевание под контролем. Пользуясь этими достижениями, вы сможете вести долгую счастливую жизнь, если будете придерживаться врачебных рекомендаций относительно диеты, физических нагрузок, мониторинга сахара крови и, при необходимости, схемы приема снижающих уровень сахара в крови лекарств.
В основном благодаря старению населения и увеличению числа граждан, страдающих избыточным весом, сахарный диабет стал одной из самых распространенных болезней в развитых странах. По мере старения человека и повышения его веса повышаются и ваши шансы заболеть сахарным диабетом. К сожалению, почти треть больных даже не догадывается об этом. Сахарный диабет может развиваться исподволь, в течение многих лет, не проявляя себя никакими явными симптомами.
Оставленный без лечения диабет может привести к поражению практически всех жизненно важных органов. Болезнь может оказаться смертельной. Именно поэтому надо начинать лечение диабета сразу же после установления диагноза. Изменение образа жизни и прием соответствующих лекарств позволит вам избежать или уменьшить риск развития опасных осложнений. Изменение образа жизни может предотвратить развитие явного сахарного диабета, если у вас повышен риск этой болезни.
Диабет – серьезная болезнь, но ее течение можно контролировать. Если вы примете посильное участие в этом контроле, то сможете, несмотря на болезнь, наслаждаться нормальной, здоровой жизнью.
Понимание того, как ваш организм использует сахар, поможет вам понять, что такое сахарный диабет и как он возникает.
Сахар, который называется глюкозой, поступает в кровь из двух источников – из пищи и из печени. В процессе пищеварения сахар всасывается в кровь из частичек съеденной пищи в желудке и в тонком кишечнике. Этот сахар необходим для поддержания энергетического баланса в отдельных клетках, из которых состоят мышцы и другие ткани. Однако для того, чтобы стать источником энергии, глюкоза нуждается в спутнике и помощнике, каковым является инсулин. Гормон инсулин поступает в кровь из мелких клеток в поджелудочной железе. Эти клетки называются бета-клетками. Они расположены отдельными скоплениями в толще ткани поджелудочной железы. Эти скопления называются островками. Когда вы едите, поджелудочная железа начинает вырабатывать инсулин, который и поступает в кровь. Циркулируя в крови, инсулин играет роль ключа, который отпирает для находящегося в крови сахара «двери» в клеточных мембранах, и глюкоза получает возможность поступать внутрь клеток. Обеспечивая поступление сахара в клетки, инсулин снижает его содержание в крови и предупреждает накопление в ней больших количеств глюкозы. Когда же концентрация глюкозы в крови падает, то уменьшается и секреция инсулина поджелудочной железой.
Наряду с этим печень является местом, где сахар хранится и вырабатывается. Когда в крови высок уровень инсулина, печень накапливает сахар на случай, когда клеткам в какой-то ситуации экстренно потребуется источник энергии. Когда уровень инсулина в крови низок, например, если вы долго не ели, то печень расщепляет запасы сахара (гликогена) до глюкозы и высвобождает ее в кровь, что позволяет поддерживать уровень сахара в ней в узком и безопасном диапазоне.
Помимо инсулина существуют и другие гормоны, участвующие в поддержании и регулировании уровня сахара в крови. Правда, эти так называемые контринсулярные гормоны обладают противоположным действием. В некоторых ситуациях такие гормоны, как глюкагон, адреналин, соматотропин и кортизол, противодействуют эффектам инсулина и препятствуют поступлению глюкозы в клетки. Под влиянием этих же гормонов печень выделяет глюкозу в кровь. Благодаря координированной и согласованной деятельности такой системы организм способен тонко регулировать содержание сахара в крови и поддерживать его уровень в нормальных границах.
У больных сахарным диабетом этот тонкий механизм регуляции разлаживается. Вместо того чтобы транспортироваться в клетки, глюкоза остается в крови, уровень сахара повышается, и глюкоза начинает выделяться из организма с мочой. В большинстве случаев такое положение складывается по одной из следующих причин: либо поджелудочная железа не способна вырабатывать инсулин, либо клетки не отвечают на воздействие инсулина.
На медицинской латыни сахарный диабет называют diabetesmellitus. (mellitus– медовый, сладкий; прилагательное отражает повышение уровня сахара в крови и в моче).
Содержание сахара в крови
В норме содержание сахара в крови варьирует, но в весьма узких границах. Натощак уровень сахара в крови здорового человека равен 70–110 мг на 100 мл (мг%). В некоторых случаях уровень глюкозы выражают в ммоль/л, и тогда нормальными параметрами будут 4,1–5,9 ммоль/л. Такая концентрация, которая приблизительно соответствует одной чайной ложке сахара на 4 л воды, считается нормальной.
Для пересчета специалисты используют следующие коэффициенты:
- уровень глюкозы (мг%) - 0,0055 = уровень глюкозы (ммоль/л);
- уровень глюкозы (ммоль/л) - 18 = уровень глюкозы (мг%).
Если уровень сахара в вашей крови натощак постоянно равен 126 мг% или выше, то у вас диабет. Раньше диагноз сахарного диабета ставили, если уровень глюкозы крови достигал 140 мг% или выше. Но в 1997 г. ученые пришли к выводу, что при уровне 140 мг% у многих больных уже развиваются органные поражения, а значит, диабет надо лечить до развития его осложнений.
Если уровень сахара в вашей крови находится между 111 и 125 мг%, то вы страдаете нарушением толерантности к глюкозе, пограничным диабетом или предиабетом. Не следует легкомысленно относиться к предиабету. Его следует воспринимать столь же серьезно, как и истинный диабет, так как пограничный диабет означает, что вы находитесь на грани высокого риска заболеть клинически явным диабетом. Вам следует регулярно показываться врачу и принимать меры по контролю уровня сахара в крови.
Увеличение содержания глюкозы в крови (гипергликемия) наблюдается при:
- сахарном диабете;
- поражении ЦНС, вызванной травмой, опухолью головного мозга;
- тяжелых поражениях печени;
- активации щитовидной железы, гипофиза, надпочечников;
- заболеваниях поджелудочной железы;
- стрессах;
- ожогах;
- обильном приеме углеводов с пищей;
- после приема кофеина, адреналина, стрихнина, диуретина и др. препаратов;
- после диализа.
Физиологическое повышение содержания в крови углеводов после еды называется алиментарной гипергликемией. Уровень углеводов начинает расти через 10—15 мин. после еды, примерно через час достигает своего пика и возвращается к исходному или даже несколько меньшему значению через 2–2,5 часа. Кратковременная физическая нагрузка вызывает повышение концентрации глюкозы в крови, а длительная ее снижает.
Гипогликемия отмечается при:
- передозировке инсулина;
- голодании;
- гиперинсулинизме;
- инсулиноме;
- гормональной недостаточности щитовидной железы, гипофиза, надпочечников.
Когда концентрация глюкозы в цельной капиллярной (венозной) крови натощак превышает 7,8 ммоль/л или если при случайном определении она составляет 11,1 ммоль/л и больше, врач должен поставить диагноз сахарного диабета.
Если же диагноз не ясен, проводят тест на толерантность к глюкозе. Он заключается в следующем.
В течение трех суток обследуемый должен соблюдать привычную диету (не ограничивая себя нарочно в потреблении углеводов) и придерживаться обычного уровня физической активности (не заниматься тяжелым физическим трудом). Также во время проведения пробы нельзя ни курить, ни пить кофе. Тест следует отложить, если у пациента повышена температура.
Утром натощак у пациента берут кровь из пальца и определяют в ней концентрацию глюкозы. После этого ему предлагают выпить раствор, содержащий 75 г глюкозы в 200 мл теплой кипяченой воды или в 200 мл жидкого чая с лимоном. Глюкозу можно заменить сахаром.
Обследуемый должен выпить раствор с глюкозой не больше чем за 5 мин. Затем у него еще 2 раза берут из пальца кровь для определения уровня глюкозы: через 60 мин. и 120 мин.
Для детей сахарная проба проводится так же, только необходимо пересчитать количество глюкозы в соответствии с возрастом и весом тела. В возрасте от 1,5 до 3 лет следует давать глюкозу из расчета 2 г/кг массы тела; от 3 до 12 лет – 1,75 г/кг; после 12 лет – 1,25 г/кг, но не более 75 г.
Динамика изменения концентрации глюкозы в крови после нагрузки такова:
Таблица 8
Диагностический уровень концентрации глюкозы (ммоль/л)
Глава 7. Газы крови и кислотно-щелочное равновесие
Газы крови: кислород (О2) и углекислый газ (СО2)
Перенос кислорода
Для выживания человек должен быть способен поглощать кислород из атмосферы и транспортировать его клеткам, где он используется в метаболизме. Некоторые клетки могут короткое время вырабатывать небольшое количество энергии без участия кислорода (анаэробный метаболизм). Другие органы (например, головной мозг) состоят из клеток, которые могут существовать только при наличии постоянного снабжения кислородом (аэробный метаболизм). Различные ткани имеют различную степень толерантности к аноксии (отсутствию кислорода). Мозг и сердце – наиболее уязвимые органы. В начале недостаток кислорода поражает функцию органа, а с течением времени вызывает и необратимые морфологические изменения (в случае с мозгом это происходит в течение считанных минут), когда восстановление функции невозможно.
В покое клетки нашего тела потребляют около 300 л кислорода в сутки, или 250 мл в минуту. При физических упражнениях или работе потребность в нем может возрасти в 10—15 раз. Если бы кислород, приносимый кровью тканям, был просто растворен в плазме, крови нужно было бы циркулировать в организме, даже находящемся в состоянии покоя, со скоростью 180 л в минуту, чтобы доставить достаточное количество этого газа клеткам, так как кислород не особенно хорошо растворим в плазме. В действительности, когда человек отдыхает, кровь циркулирует в его сосудах со скоростью около 5 л в минуту и переносит весь кислород, необходимый клеткам. Разница между 180 и 5 л в минуту обусловлена функцией гемоглобина.
Гемоглобин – это пигмент красных кровяных клеток, осуществляющий перенос почти всего кислорода и большей части углекислоты. Кровь, находящаяся в равновесии с альвеолярным воздухом, находящимся в легких, может содержать в растворе только 0,25 мл кислорода и 2,7 дл углекислоты на 100 мл, но благодаря гемоглобину 100 мл крови могут нести около 20 мл кислорода и 50—60 мл углекислоты.
Примерно 2% кислорода крови растворено в плазме, остальное же количество находится в соединении с гемоглобином. После того как кислород входит в кровь легочных капилляров, он диффундирует из плазмы в эритроциты и соединяется с гемоглобином – одна молекула кислорода присоединяется к одной молекуле гемоглобина с образованием молекулы оксигемоглобина.
Гемоглобин < – > Оксигемоглобин
Стрелки показывают, что эта реакция обратима, т. е. она может идти в любом направлении в зависимости от условий. Гемоглобин, разумеется, приносил бы организму мало пользы, если бы он мог только принимать кислород, но не отдавал бы его там, где это необходимо. В легких реакция идет слева направо, с образованием оксигемоглобина, а в тканях – справа налево, с освобождением кислорода. Различный цвет артериальной и венозной крови обусловлен тем, что оксигемоглобин имеет ярко-красную окраску, а гемоглобин – пурпурную. Соединение кислорода с гемоглобином и расщепление оксигемоглобина регулируется двумя факторами: прежде всего количеством присутствующего кислорода и в меньшей степени – количеством углекислоты. В легких концентрация кислорода относительно высока, и там образуется оксигемоглобин. Выйдя из легких, кровь проходит через сердце и артерии, где концентрация кислорода почти не меняется, к тканям, которые бедны кислородом. Здесь оксигемоглобин расщепляется, освобождая кислород, который диффундирует в тканевые клетки.
Углекислота, соединяясь с водой, образует угольную кислоту Н2СО3; поэтому при повышении концентрации СО2 кислотность крови возрастает. Способность гемоглобина переносить кислород при этом уменьшается; таким образом, соединение гемоглобина с кислородом отчасти регулируется количеством СО2. Это создает чрезвычайно эффективную систему переноса. В капиллярах тканей концентрация углекислоты высока; действие низкого напряжения О2 в сочетании с действием высокого напряжения СО2 ведет к освобождению кислорода гемоглобином. В капиллярах легких (или жабр у рыб) напряжение СО2 ниже, и под действием высокого напряжения О2 и низкого напряжения СО2 гемоглобин присоединяет к себе кислород. Важно помнить, что чем больше в крови углекислоты, тем более кислую реакцию имеет кровь, а в кислом растворе способность гемоглобина переносить кислород понижена.
Направление и скорость диффузии фактически определяются парциальным давлением, или напряжением, данного газа. В газовой смеси каждый газ производит независимо от остальных газов то же самое давление, которое он создавал бы один. На уровне моря, где общее давление воздуха равно 760 мм рт. ст., кислород создает давление 150 мм рт. ст. Иными словами, парциальное давление (напряжение) кислорода в атмосфере равно 150 мм рт. ст. Так как в альвеолярном воздухе кислорода меньше, чем в атмосферном, то парциальное давление кислорода в альвеолах составляет около 105 мм рт. ст. Кровь проходит через легочные капилляры слишком быстро, чтобы прийти в полное равновесие с альвеолярным воздухом, так что давление кислорода в артериальной крови несколько ниже – около 100 мм рт. ст. Парциальное давление кислорода в тканях колеблется от 0 до 40 мм рт. ст., поэтому кислород диффундирует из капилляров в ткани. Однако из крови выходит не весь кислород, кровь протекает через капилляры слишком быстро, чтобы могло быть достигнуто полное равновесие, и кроме того ткани обычно содержат остаточный кислород. В венозной крови, возвращающейся к легким, давление кислорода равно около 40 мм рт. ст. В артериальной крови, где парциальное давление кислорода равно обычно 100 мм рт. ст., на каждые 100 мл крови приходится около 19 мл кислорода. При напряжении О2, свойственном венозной крови (40 мм рт. ст.), в каждых 100 мл крови содержится 12 мл кислорода. Разность в 7 мл представляет количество кислорода, отданное тканям каждыми 100 мл крови. Таким образом, 5 л крови нашего тела за каждый кругооборот по организму могут передавать тканям 350 мл кислорода.
Перенос углекислоты
Перенос углекислоты представляет для организма особую проблему, так как при растворении углекислота быстро превращается в угольную кислоту.
В покое клетки выделяют около 200 мл углекислоты в 1 мин. Если бы она была просто растворена в плазме (которая может переносить в растворенном состоянии только 4,3 мл углекислоты на 1 л), то кровь должна была бы циркулировать со скоростью 47 л/мин вместо 4–5 л/мин. Кроме того, при таком количестве углекислоты кровь имела бы рН 4,5, клетки же способны выживать лишь в узких пределах рН в области слабо щелочной реакции, близкой к нейтральной (при рН примерно от 7,2 до 7,6). Гемоглобин благодаря своим уникальным свойствам позволяет каждому литру крови переносить из тканей к альвеолам около 50 мл углекислоты, причем кислотность артериальной и венозной крови различается лишь на несколько сотых долей единицы рН. Часть углекислоты находится в непрочном химическом соединении с гемоглобином, небольшое количество присутствует в виде угольной кислоты, большая же часть угольной кислоты образует бикарбонаты в результате нейтрализации ионами натрия и калия, освобождающимися при превращении оксигемоглобина в гемоглобин. Химические детали этого процесса сложны и не могут быть рассмотрены в этой книге. Интересно отметить, что в ходе эволюции возникло химическое соединение (гемоглобин), обладающее всеми свойствами, необходимыми для обслуживания процесса дыхания: способностью переносить кислород и углекислоту и поддерживать рН крови на постоянном уровне в течение всех фаз этого переноса газов.
Углекислота переходит из тканей в кровь и из крови в альвеолы, диффундируя из области с более высоким парциальным давлением в область с более низким давлением. Давление углекислоты в тканях составляет около 60, в венозной крови – около 47, а в альвеолах – около 35 мм рт. ст. Парциальное давление углекислоты в артериальной крови равно около 41 мм рт. ст., так что кровь содержит много углекислоты и после того, как она прошла через легкие. Превращение углекислоты в угольную кислоту в капиллярах тканей и обратное превращение угольной кислоты в углекислоту ускоряется примерно в 1500 раз особым ферментом, называемым угольной ангидразой.
Когда процесс нормального удаления углекислоты легкими нарушается, например при воспалении легких, ее концентрация (фактически концентрация бикарбонатов и угольной кислоты) в крови возрастает, и такое состояние крови называется ацидозом. Это не означает, что кровь действительно становится кислой (ее реакция все еще остается несколько щелочной); просто происходит уменьшение щелочного резерва крови (главным образом натрия). Когда щелочной резерв крови оказывается исчерпанным, кровь уже не может сохранять щелочную реакцию, ее рН изменяется, и клетки тканей погибают от воздействия кислой крови. Ацидоз наблюдается также при диабете. Здесь, однако, это связано не с недостаточным удалением углекислоты легкими, а с избыточным образованием кислот тканями вследствие нарушенного обмена углеводов.
Кислотно-щелочное равновесие
Кислотно-щелочное равновесие (КЩР, кислотно-основное состояние, кислотно-щелочной баланс, равновесие кислот и оснований) – относительное постоянство концентрации водородных ионов во внутренних средах организма, обеспечивающее полноценность метаболических процессов, протекающих в клетках и тканях.
Обмен веществ и энергии в тканях нуждается в непрерывном поступлении кислорода и выведении углекислоты, образующейся в результате метаболических превращений веществ. Кислород в клетки и углекислота из клеток переносятся кровью, которая является важнейшим компонентом внутренней среды организма. Помимо углекислоты кровь содержит и другие кислые продукты, например молочную, бета-оксимасляную кислоты, а также основания. Реакция жидкостей организма зависит от соотношения в них кислот и оснований; состоянию КЩР соответствует величина рН крови в диапазоне от 7,37 до 7,44; в эритроцитах рН составляет 7,19 х 0,02 и отличается от рН крови на 0,2 единицы рН. Колебания рН крови, выходящие за диапазоны нормальных значений, свидетельствуют о патологических изменениях обмена веществ (метаболические ацидоз и алкалоз) или дыхания (респираторные ацидоз и алкалоз).
Для поддержания КЩР в организме существуют эффективные системы, способные обеспечить выведение или нейтрализацию водородных ионов (ионов Н+) при их избытке или задержку ионов Н+ в организме при их дефиците. К таким системам относятся: буферные системы крови, дыхательная система (легкие) и выделительная система (почки).
Нарушения кислотно-щелочного равновесия. В тех случаях, когда компенсаторные механизмы организма не могут предотвратить нарушения КЩР, развиваются два патологических состояния, противоположных по своей направленности: ацидоз и алкалоз. При ацидозе концентрация ионов Н+ выше нормы; при этом рН крови ниже нормы. При уменьшении концентрации ионов Н+ и соответственном повышении значения рН крови развивается алкалоз. Состояния, при которых рН ниже 6,8 и выше 8,0, не совместимы с жизнью. Однако на практике такие значения рН крови, как 6,8 и 8,0, не наблюдаются.
Ацидоз и алкалоз могут возникнуть вследствие различных причин, но в основном к нарушению КЩР приводят три патологических процесса: нарушение выведения углекислого газа легкими, избыточное образование кислых продуктов в тканях и нарушение выведения из организма оснований с мочой, по€том и др. Однако на практике простые формы расстройства КЩР встречаются реже, чем комбинированные, обусловленные воздействием различных факторов.
Исследование КЩР проводят в артериальной, венозной или капиллярной крови. Застой крови при ее взятии должен быть минимальным и как можно менее продолжительным. В том случае, если для исследования нужна венозная кровь, руку пациента перед взятием крови согревают около 20 мин. при 45? Параметры, определяющие КЩР, представлены в таблице.
Таблица 9
Параметры, определяющие состояние кислотно-щелочного равновесия, и их величины в норме
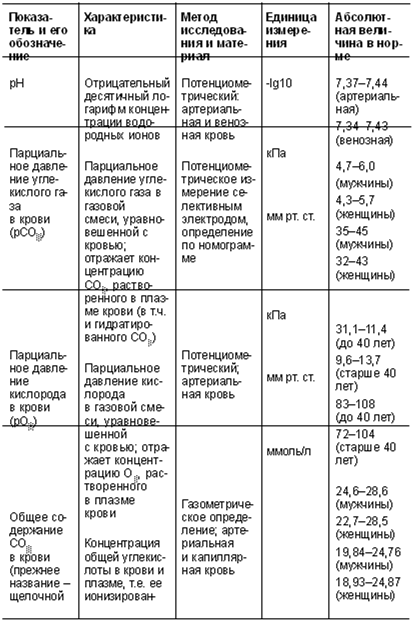
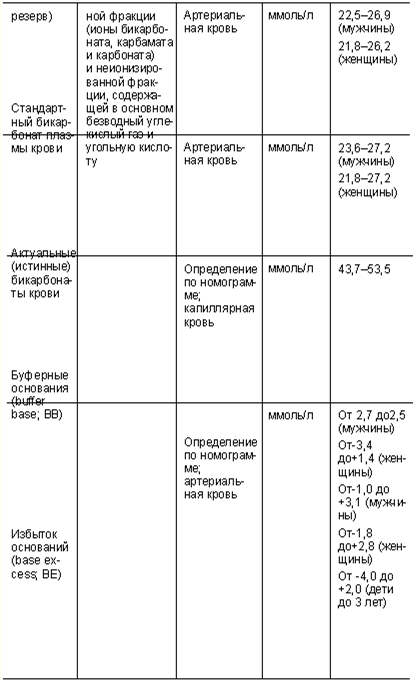
Интегральным показателем состояния КЩР может служить рН крови. Величина рН крови измеряется потенциометрически с использованием специальных рН-метров. В клинике определяют так называемый актуальный, или истинный, рН, который представляет собой рН цельной крови или плазмы, и метаболический рН, то есть рН крови или плазмы крови после соотнесения его величины с величиной рСО2. У здоровых лиц величина актуального и метаболического рН одинакова. При метаболическом ацидозе величина метаболического рН ниже, чем величина актуального рН, при респираторном ацидозе – выше. При метаболическом алкалозе величина метаболического рН выше величины актуального рН, а при респираторном алкалозе – ниже.
| Назад | Оглавление | Далее |