Медицинская реабилитация
13. Интегративные механизмы регуляции поведения, основанного на биологических мотивациях
13.1. Мотивации
Мотивации представляют собой непосредственное побуждение к действию, т.е. внутреннее состояние, стимулирующее и объясняющее различные поведенческие реакции. К. В. Судаков определил мотивации, как "эмоционально окрашенные состояния животных и человека, формирующие поведение, направленное на удовлетворение лежащих в их основе биологических и социальных потребностей" (Нормальная физиология / Под ред. К. В. Судакова. – М.: Медицинское информационное агентство, 1999). В "Словаре физиологических терминов" (М.: Наука, 1987) приводится определение П. В. Симонова: "Мотивация – физиологический механизм активирования хранящихся в памяти следов (энграмм) тех внешних объектов, которые способны удовлетворить имеющуюся у организма потребность, и тех действий, которые способны привести к её удовлетворению".
Можно выделить три важных функции мотивации. Во-первых, мотивация направляет поведение к определённой цели – удовлетворению потребности. Во-вторых, она повышает общий уровень бодрствования, стимулирует человека или животное к активным действиям. И, в-третьих, она согласует между собой отдельные компоненты поведения и определяет их необходимую последовательность.
Мотивации формируются на основе врождённых физиологических механизмов и приобретённого жизненного опыта. Уже новорождённый способен криком или плачем показывать, что он хочет есть, и успокаивается, после того, как его накормят. Питьевой, оборонительные и терморегуляционные рефлексы тоже являются врождёнными, генетически запрограммированными и вместе с пищевыми безусловными рефлексами они позволяют новорождённому удовлетворять важнейшие биологические потребности организма – в противном случае его ожидала бы гибель. Но, если биологические потребности новорождённого помогает удовлетворять мать или другие, заботящиеся о нём люди, то взрослые должны все проблемы решать сами. Путь от младенца до взрослого – это и процесс прибавления новых разнообразных механизмов управления. Они развиваются на основе существующих нервных и эндокринных способов регуляции, гетерохронного, т.е. неодновременного созревания и совершенствования различных структур мозга, отдельных синапсов и медиаторных систем; они связаны с формированием памяти о прежнем опыте успешных или, напротив, безуспешных действий, направленных на удовлетворение потребностей.
Мотивированное поведение нельзя объяснить на основе только рефлекторных механизмов ответа на лишение, например, пищи или воды, на действие чрезмерного тепла или холода. Рефлексы связаны с непосредственным действием конкретного стимула, а мотивация представляет собой комплексную форму поведения, которая одновременно зависит как от внутренних или эндогенных причин, так и от внешних обстоятельств. Кроме того, надо учитывать, что в формировании мотиваций участвуют, наряду с нервными, и эндокринные механизмы управления поведением.
13.2. Кибернетические принципы гомеостатического регулирования
Биологические потребности связаны с сохранением важнейших гомеостатических параметров: если они по какой-либо причине отклонятся от заданного значения, то автоматически срабатывают нервные и эндокринные механизмы регуляции и одновременно изменяется поведение: оно мотивируется на такие действия, которые помогают быстрее восстановить гомеостаз. Регулирование гомеостатических параметров (например, парциального давления кислорода в артериальной крови, осмотического давления крови, уровня сахара в крови, величины артериального давления и т.д.) можно рассмотреть с позиций теории управления – одного из разделов кибернетики, которая изучает информационные процессы в сложных системах. Системой в кибернетике называется совокупность взаимодействующих между собой относительно элементарных структур или процессов, объединённых в целое для выполнения общей функции. Например, в биологических системах, управление необходимо для поддержания оптимального значения того или иного гомеостатического параметра. Если повлияют внешние силы и изменят величину такого параметра, то входящие в систему звенья перестраиваются так, чтобы вернуть ему оптимальное значение (Рис. 13.1).
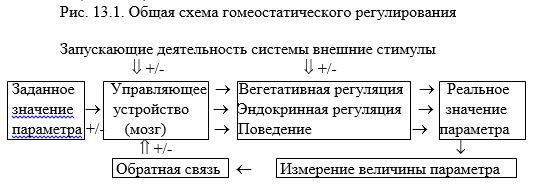
Если, например, заданное значение средней температуры тела близко к 37°, а внешняя температура (запускающий стимул) начинает повышаться (+) или понижаться (-), то соответствующая информация от наружных терморецепторов заставляет центры температурной регуляции (управляющее устройство) воздействовать на механизмы нервной и эндокринной регуляции, а также на поведение так, чтобы они и в этих условиях помогли сохранить имеющуюся температуру. Если же это не удаётся, то температура тела начнёт увеличиваться или уменьшаться, т.е. заданное значение параметра изменится. Величину отклонения от заданного значения определят внутренние терморецепторы (измерение величины параметра) и оповестят об этом (обратная связь) центры температурной регуляции. После этого активность центров меняется так, чтобы выровнять регулируемый параметр по заданному эталону. По такой же схеме кроме температуры тела регулируются и многие другие гомеостатические параметры, отклонение которых от заданного значения автоматически запускает внутренние механизмы регуляции (1) и в то же время специфически изменяет характер поведения (2).
13.3. Гипоталамус – важнейшая мотивационная структура мозга
В кибернетическом понимании гипоталамус является управляющим устройством, к которому поступает вся необходимая информация о сохранении гомеостатических параметров или их отклонении от заданного значения. На языке физиологических терминов это означает получение афферентных сенсорных сигналов от периферических рецепторов, а также способность центральных рецепторов самих гипоталамических нейронов непосредственно воспринимать изменения состава крови и ликвора.
Эти два источника поступающей в гипоталамус информации стали основой двух физиологических теорий мотиваций: периферической и центральной. В основу периферической теории легли исследования, показывавшие закономерную связь между мотивированным поведением и характером импульсации от определённых периферических рецепторов: сухость во рту, например, связывалась с формированием жажды, а периодические сокращения пустого желудка – с возникновением голода. В середине ХХ века ведущую роль в формировании мотиваций начали отдавать гипоталамическим центрам, которые в то время открывали один за другим. Позже оба подхода естественным путём объединились, поскольку информация от периферических рецепторов попадает, как известно, в гипоталамические центры и специфически изменяет их активность.
В середине 50-х годов ХХ века существовала точка зрения, что роль гипоталамуса в формировании мотиваций сводится лишь к общему сенсорному и моторному возбуждению, но вскоре стали находить специфические мотивационные механизмы голода и насыщения, питьевого и температурного поведения и т.д. Эти находки были получены во время наблюдений за последствиями электрической стимуляции отдельных регионов или ядер гипоталамуса, а также за изменениями поведения экспериментальных животных после электролитического разрушения тех или иных областей с помощью введённых в гипоталамус электродов.
В гипоталамусе имеется обильная сеть кровеносных капилляров, ни одна другая область мозга так густо ими не насыщена. Через стенки этих капилляров способны проходить такие растворённые в крови вещества, которые в других областях мозга никогда не попадут в его ткань из крови (или наоборот) в связи с особенностями строения стенок сосудов и расположением клеток глии, формирующими гематоэнцефалический барьер: в области гипоталамуса этот барьер снижен. Нейроны гипоталамуса имеют специфические рецепторы для связывания некоторых компонентов крови. Так, например, у одних клеток гипоталамуса существуют глюкорецепторы, взаимодействующие с молекулами глюкозы, а у других – рецепторы, связывающие тот или иной гормон.
Академик К. В. Судаков на основе многолетнего опыта исследования механизмов биологических мотиваций сформулировал представление о том, что различные группы гипоталамических нейронов используют для своих обменных процессов только определённые гуморальные факторы, т.е. обладают химической избирательностью. Если их внутренняя потребность в таком веществе не удовлетворяется, они приходят в состоянии возбуждения. Различные группы однородных в своей химической избирательности нейронов образуют разные мотивационные центры гипоталамуса. Специализация нейронов может состоять и в том, что одни из них активируются снижением уровня глюкозы в крови, а другие – повышением, есть нейроны, чувствительные к величине осмотического давления, уровня норадреналина в крови и т.д.
Возбуждение нейронов мотивационных центров происходит постепенно: по мере нарастания метаболической потребности достигается критический уровень их деполяризации и, вследствие этого, нейроны начинают ритмически генерировать потенциалы действия до тех пор, пока потребность не будет удовлетворена (Рис. 13.2).
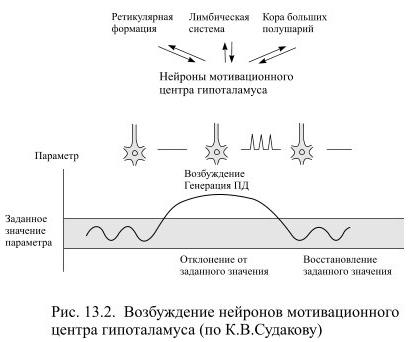
Это триггерный механизм деятельности, которая происходит периодично: нейроны ритмически разряжаются при возникновении потребности и успокаиваются, когда потребность будет удовлетворена.
Мотивационные центры гипоталамуса взаимодействуют с ретикулярной формацией, активность которой повышает общий уровень бодрствования и этим способствует эффективности действий, направленных на удовлетворение потребности. Гипоталамус имеет двусторонние связи со структурами лимбической системы мозга – именно этим определяется эмоциональная окраска мотивированного поведения. Наконец, у гипоталамуса существуют двусторонние связи с корой больших полушарий, в особенности с лобными долями, необходимыми как для создания двигательных программ, так и для определения эмоциональных аспектов поведения. Если возникает метаболическая потребность, то больше других структур чувствительный к этому гипоталамус активирует все связанные с ним области мозга, выполняя тем самым функцию пейсмекера – водителя ритма их активности. В свою очередь, связанные с гипоталамусом структуры мозга способны тормозить или усиливать его активность. Особая роль в этом отношении принадлежит коре, тормозящие влияния которой могут подавить или отсрочить удовлетворение той или иной потребности: например, многие верующие люди сознательно ограничивают себя в еде во время поста.
Изучение влияния нейротрансмиттеров на нейроны гипоталамуса показало, что разные вещества по-своему изменяют характер поведения. Так, например, нанесение норадреналина на паравентрикулярные ядра гипоталамуса сильно стимулирует аппетит, причём, при возможности выбирать ту или иную пищу, подопытные животные предпочитают продукты с высоким содержанием углеводов. Точно так же действует и самый сильный возбудитель аппетита – нейропептид Y, а ещё один пептид – галанин избирательно повышает потребление жиров.
Некоторые вещества, способные изменять характер поведения, попадают в гипоталамус из крови, проходя через гематоэнцефалический барьер. Так, например, ангиотензин, образующийся в повышенном количестве при уменьшении объёма циркулирующей крови, проникает в гипоталамус и активирует в нём группу чувствительных нейронов, что приводит, в конечном счете, к усиленному потреблению воды. Некоторые пептидные гормоны образуются в двенадцатиперстной кишке и верхнем отделе тонкого кишечника в связи с поступлением туда пищи (например, холецистокинин, бомбезин и т.п.). Они попадают в кровь в очень небольших количествах, однако определённые нейроны гипоталамуса к этому высоко чувствительны: действие таких гормонов ведёт к уменьшению или прекращению приёма пищи. К таким же последствиям приводит и действие гормона поджелудочной железы инсулина, способного медленно проникать из крови в ликвор: в гипоталамусе найдены места связывания инсулина.
Таким образом, гипоталамус, обладающий всей информацией о состоянии внутренней среды организма, способен управлять её гомеостатическими параметрами с помощью нервных и эндокринных механизмов регуляции на основе уже имеющихся, накопленных ранее резервов. Но, кроме того, гипоталамус ещё и побуждает другие области мозга специфически изменить поведение, направить организм на такие действия, которые обеспечат восстановление потраченных ресурсов или их заготовку впрок.
13.4. Лимбическая система мозга
В 1937 году нейроанатом Джеймс Папец (Papez J.) обратил внимание на существование многочисленных связей между структурами мозга, расположенными в виде кольца в области соединения ствола и полушарий, и предложил объединить их в лимбическую систему (лат. limbus – кайма). Кольцо лимбической системы образуют мамиллярные тела, гиппокамп, миндалины и свод, проходящий дугой от гиппокампа к мамиллярным телам и перегородке. Нейроны перегородки образуют несколько пучков аксонов, соединяющих её с мамиллярными телами, миндалинами и гиппокампом – в результате образуется кольцо, по которому может циркулировать возбуждение.
В лимбическую систему принято также включать соседние области древней и старой коры мозга: прилегающие к гиппокампу грушевидные доли и поясные извилины – они занимают медиальную поверхность больших полушарий непосредственно над мозолистым телом и, как пояс, огибают таламус. Лимбические структуры связаны хорошо развитыми проводящими путями с обонятельным мозгом и гипоталамусом (Рис. 13.3).
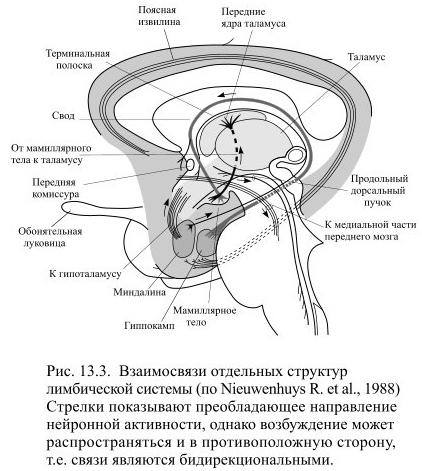
В частности гипоталамус соединён с гиппокампом и перегородкой волокнами свода, а терминальной полоской (stria terminalis) и вентральным амигдалофугальным путём – c миндалиной. Через гипоталамус лимбическая система взаимодействует со средним мозгом, через гипоталамус и передние ядра таламуса она связана с лобной корой. Гиппокамп и миндалины, расположенные в височных долях, непосредственно сообщаются с ассоциативными областями коры.
Папец высказал предположение о реципрокных отношениях гипоталамуса и кортикальных центров познания и эмоций, он считал, что, получив информацию от кольца лимбических структур, гипоталамус начинает затем взаимодействовать с корой через поясную извилину и передние ядра таламуса. Эти представления существенно пересмотрел и развил американский физиолог Пол Мак-Лин (McLean P. D.), который обосновал представление о важной роли "висцерального мозга" для регуляции эмоционального поведения и коррекции внешних и внутренних сигналов. Он также предложил модель иерархического деления мозга на три отдела в соответствии с этапами его эволюционного развития (Рис. 13.4): 1) древний мозг рептилий (ствол, промежуточный мозг и базальные ганглии); 2) старый мозг млекопитающих (структуры лимбической системы) и 3) новый мозг млекопитающих (кора больших полушарий).
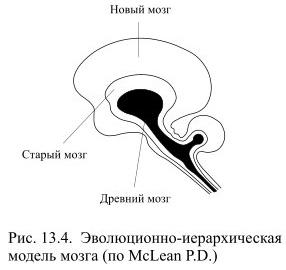
Функция древнего мозга рептилий, по мнению Мак-Лина, заключается в контроле врождённых поведенческих актов; такой мозг недостаточно пластичен и обеспечивает выживание только при постоянных условиях среды. Древний мозг млекопитающих ("висцеральный мозг") формирует эмоции, увеличивает объём памяти и даёт возможность возникновения простых форм поведения. Новый мозг прибавляет возможность произвольного управления эмоциями, прогнозирования поведения и т.п. Мак-Лин рекомендовал не забывать, что в каждом человеке присутствует мозг лошади и крокодила, и с этим обстоятельством порой приходится считаться.
Изучение функций лимбической системы проводилось путём наблюдения за последствиями удаления или разрушения отдельных её структур (например, миндалин, гиппокампа), электрической стимуляции этих структур, регистрации их электрической активности (с помощью вживлённых электродов) при различных формах поведения. Использование методов нейрохимии и нейрофармакологии позволило обнаружить различные нейромедиаторы и рецепторы у нейронов, входящих в состав лимбической системы.
Применение метода самораздражения (См. 13.5) позволило обнаружить такие структуры мозга, электрическая стимуляция которых вызывает приятные или, напротив, неприятные ощущения. К позитивным эмоциогенным зонам относятся латеральный и перивентрикулярный гипоталамус, перегородка, покрышка среднего мозга: здесь сосредоточены тела или аксоны моноаминэргических нейронов, использующих в качестве медиаторов дофамин или норадреналин. Негативных эмоциогенных зон в мозгу гораздо меньше, чем позитивных, а многие структуры (и в том числе, по-видимому, гиппокамп) нейтральны – их стимуляция не сопровождается приятным или неприятным ощущением (в мозгу крысы около 60% структур нейтральны, раздражение 35% исследованных областей мозга вызывает удовольствие, а стимуляция остальных 5% – страдание). В мозгу человека также оказалось больше областей, раздражение которых вызывает приятные ощущения или удовольствие.
13.5. Роль мезолимбической системы в формировании мотиваций
Классическая теория мотиваций объясняла их возникновение и прекращение по следующей схеме: лишение еды или питья, температурного комфорта или полового партнёра (для такого рода ограничений часто используется термин депривация) приводит к мотивированному поведению, в результате которого существующая потребность удовлетворяется, а как только будет достигнута эта цель, мотивация просто утратит смысл. В начале 50-х годов ХХ столетия Дж. Олдс (Olds J.) выполнявший диссертацию под руководством профессора П. Милнера (Milner P.), исследовал поведение крыс со вживлёнными в мозг стимулирующими электродами. Обычно крысы, подвергнувшиеся неприятному электрическому разряду, не возвращались в то место, где на них действовал ток. Но как-то одна из подопытных крыс стала регулярно к нему возвращаться. Тогда Олдс, посчитав что у этой крысы низкий порог чувствительности, увеличил силу раздражителя, но добился только того, что крыса ещё охотнее стала возвращаться к месту электрической стимуляции. При вскрытии животного было установлено, что стимулирующий электрод оказался в заднем отделе гипоталамуса, что первоначально не планировалось в экспериментах Олдса.
Тогда Олдс и Милнер вживили электроды в эту же область мозга другим крысам, а в клетке, куда их помещали, сделали педаль, при нажатии на которую замыкалась электрическая цепь, и мозг немедленно подвергался действию тока (Рис.13.5).

Это нововведение привело к открытию феномена самораздражения: крысы непрерывно нажимали на педаль (отдельные животные делали это несколько тысяч раз на протяжении одного лишь часа) и явно предпочитали такое занятие даже приёму пищи, несмотря на предшествующее голодание в течение суток. Так возникло представление о "центрах удовольствия (поощрения)".
Дальнейшими исследованиями такие центры были найдены и в других областях мозга, а наряду с ними удалось обнаружить структуры, стимуляции которых животные всячески стремились избежать – эти регионы представляют собой "центры избегания (наказания)". Известный исследователь мозга Г.Мэгун (Magoun H. W.) задал в связи с этими экспериментами хороший риторический вопрос: "Не находится ли рай и ад в мозгу животного?" Вскоре этот вопрос стал уместным и применительно к мозгу человека, в котором также были найдены как центры удовольствия, так и области, раздражение которых сопровождалось неприятными ощущениями. Всё это позволило рассматривать мотивации с гедонистической точки зрения (от греч. hedone – удовольствие), согласно которой поведение мотивируется не только неприятными ощущениями, побуждающими к определённым действиям, но и получением удовольствия от результата таких действий. В процессе приобретения жизненного опыта образуются следы памяти о совпадении определённых действий с исчезновением неприятных ощущений и получением удовольствия, и эта память начинает использоваться в дальнейшем.
В настоящее время известно, что переживание удовольствия связано с активацией областей мозга, которые иннервирует мезолимбическая система, образованная дофаминэргическими нейронами (Рис. 13.6).
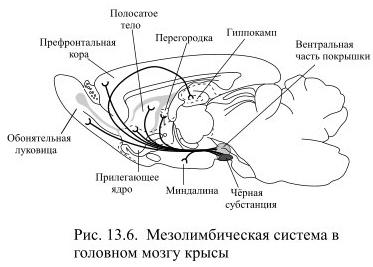
Их тела находятся в области вентральной покрышки среднего мозга, а аксоны оканчиваются в префронтальной и лимбической коре, перегородке, обонятельной луковице, миндалинах и прилегающем ядре (nucleus accumbens), расположенном кпереди от полосатого тела. Экспериментальное исследование этих областей мозга в последние годы проводилось с помощью введённых в них микроканюль (тончайших трубочек), через которые удаётся получать образцы внеклеточной жидкости для исследования, а также медленно вводить через них различные фармакологические вещества. Такие исследования позволили обнаружить, на какой стадии мотивированного поведения из окончаний мезолимбических нейронов выделяется больше всего дофамина: во время мотивированного поведения, направленного на удовлетворение потребности, или при достижении результата?
В одном из опытов голодных крыс помещали в одну из половин разделённой перегородкой клетки, а на другой половине находилась привлекательная для них еда, которая была для животных недоступна. Через 20 минут перегородку убирали и тогда крысы могли есть. Этот опыт повторяли на протяжении двух недель, чтобы у крыс образовался определённый поведенческий опыт, а затем определяли уровень дофамина в добытой через микроканюлю внеклеточной жидкости прилегающего ядра (n. accumbens). Обнаружилось, что во время ожидания корма он не выше среднего значения, но после еды дофамин выделяется в заметно большем количестве. В другом эксперименте, выполненном по такой же схеме, в одну половину клетки помещали самца крысы, а в другую – самку, находящуюся в состоянии течки. И здесь было найдено, что выделение дофамина связано не с приближением полового партнёра, а с последующим спариванием.
После избирательного повреждения нейронов мезолимбической системы специфическим токсином (6-гидрооксидофамин) на одной стороне мозга подопытные животные перестают пользоваться вживлёнными с этой стороны электродами для самораздражения, но продолжают раздражать у себя центры удовольствия на другой стороне мозга: при этом в прилегающем ядре повышается концентрация дофамина. Если вводить через микроканюлю антагонисты дофамина, то животные либо прекращают, либо уменьшают самораздражение. Таким образом, дофаминэргические нейроны обеспечивают "награду" за совершённые действия (можно сказать, что мозг сам себя награждает) и такая деятельность становится, по мере приобретения опыта, важным механизмом активации поведения, усилением средств поиска.
Нельзя не отметить, что ряд наркотических веществ, от действия которых человек или животное может попасть в зависимость, усиливают выделение дофамина или препятствуют его нормальному расщеплению, поддерживая тем самым, повышенную концентрацию. Здесь складывается ситуация, по сути напоминающая действия крысы, непрерывно нажимающей на педаль для получения удовольствия.
13.6. Физиологические механизмы боли
При механическом, термическом или химическом повреждении тканей организма возбуждаются особые рецепторы с высоким порогом чувствительности. Это болевые рецепторы или ноцицепторы, принадлежащие афферентным нейронам, тела которых располагаются в спинальных ганглиях. В составе задних корешков спинного мозга возбуждение поступает в спинной мозг, где в задних рогах происходит первое переключение сигналов в ноцицептивной системе. Нейроны задних рогов спинного мозга передают полученную информацию дальше с помощью своих аксонов, которые переходят через переднюю серую спайку на противоположную сторону и двумя-тремя сегментами выше входят в состав переднебокового канатика, поднимающегося к таламусу и образующего таким образом спиноталамический тракт. Часть восходящих в переднебоковом канатике аксонов направляется к нейронам ретикулярной формации – это спиноретикулярный тракт (Рис. 13.7).
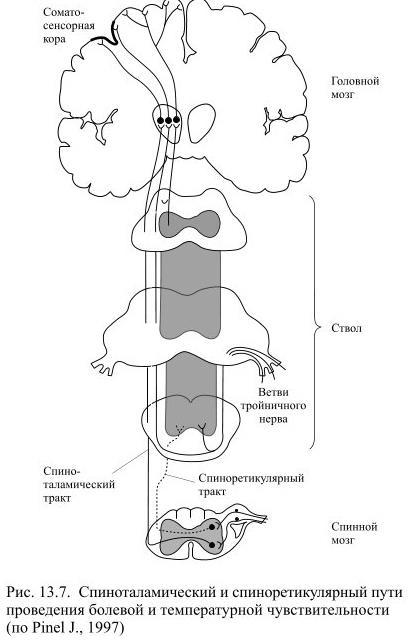
Спиноталамический тракт позволяет точно определять место действия болевого стимула, поскольку он заканчивается на тех же ядрах таламуса, где переключаются проводники тактильной и проприоцептивной чувствительности. Конвергенция тактильных и болевых сигналов на одних и тех же нейронах таламуса обеспечивает их одновременную проекцию преимущественно на первичную соматосенсорную кору.
Спиноретикулярный тракт заканчивается диффузно в нескольких областях ретикулярной формации ствола мозга. Получающие сигналы нейроны ретикулярной формации связаны с медиальными ядрами таламуса. Нейроны этих ядер таламуса не имеют определённого представительства в коре, их отростки веерообразно распределены по разным её регионам. Считают, что переданная по спиноретикулярному пути информация от болевых рецепторов играет роль сигнала общей тревоги, оказывает общее возбуждающее действие.
Относительно недавно методом позитронно-эмиссионной томографии было установлено, что при болевом раздражении всегда повышается активность передней части поясной извилины, которая является компонентом лимбической системы мозга. Эта активность связана с поступлением информации по спиноретикулярному пути к медиальному таламусу, а от него – к поясной извилине. Результатом активации лимбической системы является эмоциональная реакция на боль. Одновременно с этим ощущение боли сопровождается выраженными вегетативными реакциями. Их появление можно связать с активностью ретикулярной формации, в которой содержатся многие важные центры вегетативной регуляции.
На примере изменяющегося болевого восприятия интересно наблюдать роль нисходящего торможения. Многочисленные ноцицепторы (чувствительные окончания болевых нейронов) мультимодальны, т.е. их можно возбудить механическим воздействием (укол, щипок), термическим, химическим (если на них действуют освобождающиеся при повреждении клеток вещества типа брадикинина, серотонина, гистамина, простагландинов и т.п.), однако порог их чувствительности довольно высок. Чувствительные нейроны передают возбуждение на нейроны задних рогов спинного мозга, по-видимому, с помощью нескольких нейротрансмиттеров (чаще других упоминаются вещество Р, холецистокинин и соматостатин); возможно, что некоторые из них выполняют роль нейромодуляторов.
К этим переключательным нейронам задних рогов спускаются из головного мозга нисходящие тормозные пути, с помощью которых передача болевых импульсов может быть прервана. Нисходящие пути начинаются от нейронов головного мозга, группирующихся вокруг водопровода и в большом ядре шва: они синтезируют энкефалины, уменьшающие образование вещества Р в задних рогах. В других нисходящих путях в качестве медиаторов используются биогенные амины, основной такой путь начинается в ядрах голубого пятна, где синтезируется норадреналин. Предполагают, что он взаимодействует в спинном мозгу с альфа-адренорецепторами, а вследствие этого активируются подавляющие передачу болевой чувствительности механизмы.
Высокая плотность опиатных рецепторов обнаружена в лимбической системе и медиальной части таламуса. С этим интересно сопоставить многочисленные примеры временного снижения или даже утраты болевой чувствительности при определённых эмоциональных состояниях. У женщины во время родов, у солдата во время боя, у религиозного фанатика во время самоистязания болевой порог резко повышается, что можно объяснить как торможением передачи болевых сигналов, так и изменением характера эмоциональных реакций в ответ на болевые стимулы
13.7. Роль миндалин в образовании мотиваций
Если гипоталамус является важнейшей мотивирующей структурой мозга, активирующейся при изменении постоянства внутренней среды, то на внешние стимулы, вызывающие мотивацию или же изменяющие уже мотивированное поведение, раньше гипоталамуса откликаются нейроны миндалевидных ядер или миндалин мозга, которые относятся к лимбической системе и находятся в височных долях больших полушарий. Электрическое раздражение миндалин у людей чаще всего вызывает чувство страха и тревоги, двустороннее удаление миндалин у экспериментальных животных по-видимому лишает их чувства страха. Каков же механизм формирования такой мотивации? Поиск ответа на этот вопрос побудил к исследованию афферентных и эфферентных связей миндалин.
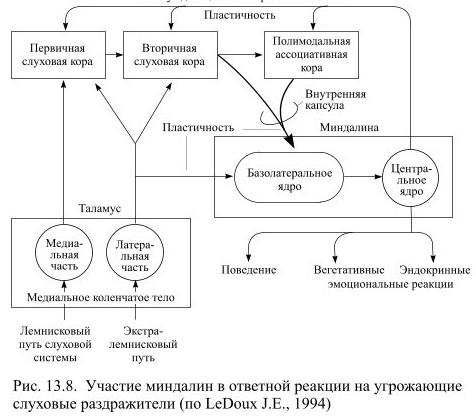
Есть два важных источника афферентной информации для миндалин: сенсорные ядра таламуса и кора, преимущественно вторичные слуховые области и полимодальные ассоциативные поля (Рис. 13.8).
При действии внешних стимулов сенсорная информация раньше поступает от таламуса и вызывает примитивную реакцию, на фоне которой приходит информация, уже переработанная в коре. Оба афферентных потока направляются к базолатеральным ядрам миндалин, где пришедшие сигналы перерабатываются и передаются нейронам центрального ядра миндалин. От клеток центрального ядра начинаются эфферентные пути миндалин, которые направляются к латеральному гипоталамусу и стволу мозга. При возникновении страха активация миндалин приводит к последующему быстрому повышению частоты сокращений сердца и артериального давления, учащению дыхания, выделению гормонов и другим проявлениям симпатоадреналовой реакции и стресса. Такими же последствиями сопровождается раздражение центрального ядра миндалины электрическим током, тогда как его разрушение приводит к исчезновению вегетативных реакций в ответ на действие стимулов, обычно вызывающих страх.
Помимо этого существует эфферентный путь от миндалин к коре, в особенности к орбитофронтальной области и поясной извилине, этот путь важен для осознания переживаемых ощущений. Кроме того, ядра миндалин имеют реципрокные соединения с гиппокампом, а также получают афферентную проекцию от гипоталамуса, хотя она и уступает по мощности эфферентным влияниям миндалин на гипоталамус. И ещё необходимо отметить связь миндалин с мезолимбической системой, прежде всего с прилегающим ядром (n. accumbens).
У кроликов можно выработать условный рефлекс на нейтральный звуковой стимул, подкрепляя его болевым действием электрического тока. Болевое раздражение всегда сопровождается повышением частоты сокращений сердца, артериального давления, учащением дыхания и т.п. Когда образуется условный рефлекс, такая же реакция наблюдается и на прежде нейтральный звуковой раздражитель, который начинает вызывать у животного состояние страха. Если теперь удалить или разрушить миндалины, либо ввести в них специфические блокаторы синаптической передачи – реакция страха исчезнет. Таким образом, не только врождённые, но и приобретённые мотивации страха связаны с обязательным участием миндалин.
Роль миндалин не сводится только к мотивации страха. Хотя при их повреждении не исчезают совсем мотивации голода или жажды, но в пищевом и питьевом поведении наступают заметные перемены. Подопытные животные перестают отличать предпочитаемую раньше вкусную пищу от невкусной и постоянно берут в рот даже несъедобные предметы. У них пропадает врождённая или выработанная до операции разборчивость в питье, и, например, подопытные крысы начинают пить растворы с неприятным для нормальных животных запахом. У них изменяется половое поведение: животные становятся гиперсексуальными и готовы спариваться даже с представителями другого вида. Таким образом, значение миндалин становится особенно заметным в тех случаях, когда для формирования мотивированного поведения одновременно требуется учесть существование нескольких внешних факторов.
13.8. Гомеостатическое и поведенческое регулирование температуры тела
Жизнедеятельность многих клеток человеческого организма, процесс их деления и развития можно наблюдать вне организма (in vitro), если, конечно, обеспечить им необходимые условия существования. Одним из обязательных условий является поддержание постоянной температуры – 37° С, поскольку большая или меньшая температура изменит скорость и характер обменных процессов и может оказаться губительной для клеток. При выращивании клеток вне организма постоянную температуру им обеспечивает термостат, в самом организме терморегуляцию осуществляют специальные механизмы гомеостатического регулирования. Кроме того, холод или жара побуждают человека к действиям, направленным на достижение температурного комфорта. Комфортно он ощущает себя в термонейтральной зоне внешней среды – примерно 27-28° С для обнажённого человека (здесь уместно напомнить о его тропическом происхождении), с помощью одежды ощущение комфорта может быть достигнуто при меньшей температуре.
Одежда препятствует выведению тепла из организма, которое отдаётся прилегающему к поверхности тела слою воздуха (теплопроведение или конвекция), излучается к предметам, нагретым меньше, чем температура поверхности тела (32-33° С), а также выделяется при испарении пота с поверхности тела. В нагретом воздухе и в окружении горячих предметов путём конвекции и теплоизлучения в организм поступает дополнительное тепло и тогда единственным способом его выведения становится потоотделение, да ещё некоторое количество тепла уходит из организма при дыхании в связи с испарением водяных паров, содержащихся в выдыхаемом воздухе.
Тепло постоянно образуется в организме в ходе обменных процессов (первичная теплота), кроме того, при совершении любой работы расщепляются обеспечивающие её энергией ранее синтезированные вещества, что также сопровождается образованием тепла (вторичная теплота). Особенно много тепла образуется в мышцах, где даже в условиях покоя поддерживается мышечный тонус, а на его поддержание расходуется энергия.
Постоянная средняя температура тела может сохраняться в том случае, когда теплоотдача и теплопродукция уравновешены. Но непостоянная температура среды то и дело изменяет теплоотдачу, а интенсивность обмена и разный объём выполняемой работы меняют теплопродукцию, отчего баланс, казалось бы, должен всё время нарушаться, однако этого не происходит благодаря эффективно действующим механизмам терморегуляции.
Центр терморегуляции находится в гипоталамусе, к которому поступает афферентная информация от холодовых и тепловых терморецепторов кожи, внутренних органов и спинного мозга. Помимо периферических терморецепторов существуют центральные, они находятся в переднем гипоталамусе, в его преоптической области. Это тепловые и холодовые термочувствительные нейроны, которые изменяют частоту своих разрядов в ответ на незначительное повышение или понижение температуры крови, протекающей через мозг. Передний отдел гипоталамуса – это термоафферентная область, здесь происходит суммация всех температурных сигналов. Регулируемым параметром оказывается средняя температура близкая к 37° С, что является заданным, установочным значением, его внутренним эталонным входом (англ. set point).
При отклонении средней температуры от заданного значения гипоталамус корректирует вегетативную и эндокринную регуляцию, а также реакции скелетных мышц, чтобы одновременными изменениями теплоотдачи и теплопродукции выровнять отклонение. Когда из-за повышения внешней температуры начинает нарастать средняя температура тела, происходит рефлекторное расширение поверхностных сосудов при одновременном сужении сосудов внутренних органов: в результате кровоток через кожу может увеличиться в несколько раз и повысить её температуру (румянец после бани обусловлен именно этим механизмом). Но, если температура среды окажется выше, чем на поверхности кожи, вывести тепло путём конвекции или теплоизлучения невозможно и единственным остающимся способом освобождения от излишков тепла становится выделение пота. Это тоже рефлекторный и управляемый гипоталамусом механизм, который реализуется с помощью холинэргических симпатических волокон, иннервирующих потовые железы. При длительном действии жары постепенно понижается интенсивность обменных процессов и уменьшается мышечный тонус. Уменьшение теплопродукции облегчает приспособление к жаре.
При действии холода происходит перераспределение кровотока от поверхностных сосудов к сосудам внутренних органов – это снижает температуру поверхности и уменьшает теплоотдаду. Наряду с этим повышается тонус мышц и может возникнуть непроизвольная мышечная дрожь, что сопровождается повышенным образованием тепла. При длительном действии холода увеличивается секреция гормонов (особенно тироксина в щитовидной железе), стимулирующих освобождение энергии и образование тепла. Реакции, направленные на сохранение тепла в организме, контролируют задние отделы гипоталамуса, которые, в отличие от переднего гипоталамуса, не имеют собственных термочувствительных нейронов, а играют роль эффекторного отдела.
Одна лишь гомеостатическая терморегуляция не может обеспечить сохранение средней температуры тела на заданном уровне. При большом диапазоне изменений температуры среды эта задача решается и с помощью поведенческой терморегуляции. Стремление к температурному комфорту заставляет искать и находить нужные условия обитания. Необходимым для этого действиям можно обучаться, что, например, обнаруживается в эксперименте с крысами, которые нажатием кнопки могли направлять в клетку холодный воздух и делали это при каждом повышении наружной температуры, но не прикасались к кнопке, если температура воздуха была равной 22° С. Человек, как известно, решает проблемы терморегуляции с помощью соответствующей одежды, отопления помещения или кондиционирования воздуха и, на основе своего опыта, стремится предупредить наступление субъективно неприятных ощущений перегревания или переохлаждения. Впрочем, постоянная жизнь в температурном комфорте ведёт к уменьшению эффективности физиологических механизмов терморегуляции и увеличивает риск простуды. Этому можно противопоставить хорошо известные средства закаливания, обеспечивающие регулярную тренировку физиологических механизмов терморегуляции.
13.9. Механизмы регуляции пищевого поведения
13.9.1. Поступление и усвоение пищи
Пища служит единственным источником энергетических и пластических, т.е. строительных ресурсов для организма. Она механически измельчается во рту, а затем расщепляется под действием ферментов желудка и кишечника на вещества, способные оттуда всасываться в кровь. Из множества самых разнообразных углеводов, жиров и белков растительного или животного происхождения получаются сравнительно простые молекулы: углеводы расщепляются до моносахаров (прежде всего это глюкоза), жиры – до жирных кислот, белки – до аминокислот. Всасывание таких веществ из кишечника в кровеносные капилляры приводит к временному повышению их концентрации в крови, которая сравнительно быстро снижается до обычного постоянного уровня по мере использования и резервирования поступивших продуктов клетками. При повышении в крови уровня сахара увеличивается секреция инсулина. Этот гормон играет важную роль в усвоении поступивших продуктов: он способствует транспорту глюкозы и аминокислот из крови в клетки печени и скелетных мышц и активирует там ферменты, необходимые для синтеза гликогена из глюкозы и белков из аминокислот. Гликоген прежде называли животным крахмалом, его сложная молекула является углеводным запасом на "чёрный день", когда не удастся добыть пищу. Если запас гликогена создан, а глюкоза продолжает поступать с пищей, инсулин стимулирует образование из неё жирных кислот, которые из печени поступают в жировую ткань – так создаётся стратегический запас энергии. В определённом смысле это выгодно, поскольку калорическая ценность жира примерно вдвое выше по сравнению с углеводами, а, кроме того, жир, в отличие от гликогена, не связывает воду и потому создание жирового запаса не требует накопления ещё и большой массы воды.
Как только повышенная приёмом пищи концентрация в крови глюкозы, аминокислот и жирных кислот постепенно понизится и достигнет заданного уровня, возникает новая задача гомеостатического регулирования. Она связана с тем, что работающие клетки забирают из крови нужные себе вещества по потребности, причём многие клетки, например нервные или миоциты сердечной мышцы, могут это делать и без инсулина (что и понятно, поскольку они никогда не создают запасов). Кроме того, многие гормоны вынуждают клетки расставаться с энергетическими запасами, стимулируя в них расщепление гликогена и образование глюкозы. Такие гормоны называют контринсулярными, к ним относятся глюкагон, соматотропин, АКТГ, катехоламины, кортизол. Свою лепту вносит и нервная система: если влияние парасимпатических нервов способствовало расщеплению пищи в желудке и кишечнике, а также выделению инсулина (то есть созданию запаса энергии), то повышенная активность симпатических нервов увеличивает расход энергии и повышает уровень сахара в крови.
На первый взгляд регуляция пищевого поведения представляется довольно простой: как только накопленные запасы будут истрачены и уровень питательных веществ в крови начнёт снижаться, наступает время принимать пищу, а когда заданное значение питательных веществ восстановится – трапезу надо закончить. Остаётся, впрочем, неясным вопрос о том, как регулировать количество запасаемого жира, который в норме обеспечивает около 85% энергетических ресурсов (в то время как белки мышц – 14,5%, а гликоген печени – лишь 0,5%)? Если запас жира начнёт расти, то станет увеличиваться и масса тела, но многие люди долгие годы сохраняют постоянный вес – как регулируется его заданное значение? Быть может, существуют разные классы сигналов: одни из них, кратковременные, для управления однократным приёмом пищи – от голода до сытости, а другие, долговременные, – для сохранения заданного значения веса тела? Многое остаётся непонятным до настоящего времени.
13.9.2. Открытие центров голода и насыщения в гипоталамусе
В 1940 году было обнаружено (Hetherington A. W., Ranson S. W.), что после электролитического разрушения (т.е. с помощью введённых электродов, через которые пропускается ток) вентромедиальной области гипоталамуса у экспериментальных животных сразу после операции возникает гиперфагия (т.е. неумеренное потребление пищи), которая быстро приводит к ожирению (Рис. 13.9).
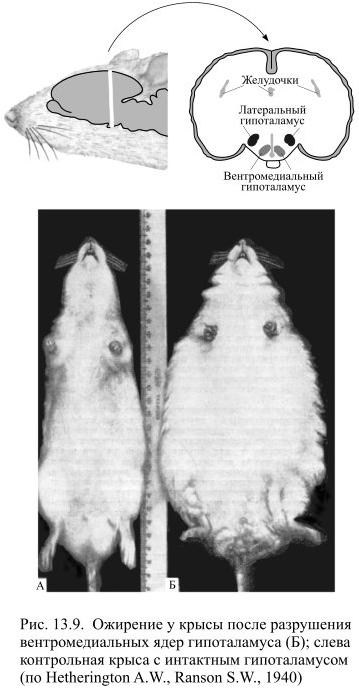
Со временем вес перестаёт расти, и одновременно крысы уменьшают потребление пищи, но стоит им немного поголодать и похудеть, как они снова увеличивают приём пищи и опять набирают свой большой вес. Его можно и ещё увеличить путём принудительного кормления животных через зонд, а после отмены такого кормления, они станут есть меньше и их вес уменьшится, но не до нормы, а до набранного после операции значения. Иными словами подопытные крысы "защищают" свой увеличенный вес подобно нормальным животным, хотя заданное значение этого веса стало иным.
В 1951 году Ананд и Бробек (Anand B. K., Brobeck J. R.) обнаружили, что после разрушения латерального гипоталамуса у крыс развивается афагия (отказ от пищи) и без принудительного кормления они могут погибнуть от голода в окружении самой вкусной еды. Если выходить их после операции путём принудительного кормления через зонд, то спустя некоторое время они начинают есть самостоятельно, хотя и меньше, чем нормальные крысы.
На основе этих открытий сложилось представление о механизме регуляции пищевого поведения двумя гипоталамическими центрами: вентромедиальный гипоталамус стал рассматриваться в качестве центра насыщения (поскольку его разрушение приводит к гиперфагии), а латеральный гипоталамус был объявлен центром голода (после его разрушения наблюдается отказ от пищи). Это представление на какое-то время оттеснило на задний план прежний взгляд на пищевое поведение, отводящий главное значение в формировании чувства голода сокращениям пустого желудка и соответствующей афферентной импульсацией от периферических рецепторов. Отказу от гипотезы периферической активации приёма пищи способствовал и хорошо известный факт регулярного возникновения чувства голода у людей, перенесших резекцию желудка, т.е. его оперативное удаление.
Сложившаяся в 40-50-х годах модель пищевого поведения объясняла чувство голода понижением уровня сахара в крови, а чувство сытости – его повышением во время еды выше заданного значения (глюкостатический механизм). Тогда же возникла гипотеза регулирования заданного значения количества жира в организме, при уменьшении или увеличении которого должно было соответственно увеличиваться или уменьшаться общее количество потребляемой пищи (липостатический механизм). В соответствии с этими представлениями понижение и повышение уровня сахара можно было считать кратковременными сигналами, действующими от начала до окончания еды, а изменения количества жира следовало рассматривать в качестве сигналов для долговременной регуляции. Если связать с этим существование специальных центров голода и насыщения в гипоталамусе, то объяснить возникновение пищевой мотивации можно очень легко. К сожалению, всё оказалось намного сложней.
13.9.3. Новые данные о центрах голода и насыщения
Постепенно выяснилось, что вентромедиальный гипоталамус вряд ли можно представлять только центром насыщения в традиционном понимании, а механизм гиперфагии, развивающейся после его разрушения, гораздо сложнее, чем казалось поначалу. Выяснилось, что разрушение вентромедиального гипоталамуса обычно сопровождается повышенной секрецией инсулина, который собственно и стимулирует образование жира из глюкозы. Это приводит к понижению уровня сахара в крови, животные начинают есть, но инсулин и этот, вновь поступивший сахар превращает в жир. Оказалось, что высокий уровень инсулина связан со стимуляцией поджелудочной железы блуждающим нервом: если перерезать веточку этого нерва, идущую к железе, то гиперфагия, возникающая после разрушения вентромедиального гипоталамуса, исчезнет, а ожирение не возникнет.
Кроме того, было установлено, что при разрушении вентромедиального гипоталамуса традиционно принятым способом повреждается ещё и большой пучок идущих к нему норадренэргических волокон, тела которых расположены в паравентрикулярных ядрах гипоталамуса. Если же повредить только эти ядра или норадренэргические волокна, направляющиеся к вентромедиальному гипоталамусу, то тоже возникнет гиперфагия и ожирение: выходит, что центром насыщения являются и эти структуры? Микроинъекция в паравентрикулярные ядра различных нейротрансмиттеров (норадреналин, ГАМК, нейропептид Y, галанин, опиоидные пептиды) стимулирует последующее потребление пищи, причём одни трансмиттеры склоняют животное к пище, богатой углеводами, а другие – жирами. В связи с этим можно предположить, что различные вещества ослабляют сигнал насыщения либо углеводами, либо жирами.
Не всё оказалось просто и с центром голода в латеральном гипоталамусе. При его разрушении, как правило, повреждаются проходящие поблизости чувствительные волокна тройничного нерва, доставляющие информацию ото рта и лица, а в настоящее время известно, что одна лишь перерезка волокон этого нерва ведёт к нарушениям пищевого поведения у крыс. В ряде случаев при разрушении латерального гипоталамуса повреждали и окружающие структуры базального переднего мозга и вентральную часть бледного шара, а такие нарушения сами по себе приводят к изменению пищевого поведения, которое выражается, например, в появлении отвращения к привлекательному корму, в частности к сахару. Кроме того, надо учесть и почти неизбежное повреждение дофаминэргических волокон, принадлежащих мезолимбической системе, а они, как известно, имеют отношение к получению удовольствия от принимаемой пищи. Можно говорить и о том, что разрушение латерального гипоталамуса приводит не только к афагии, но и к адипсии (прекращению питья), и к целому спектру моторных нарушений и общему дефициту реакций.
Какова же во всём этом роль самих нейронов латерального гипоталамуса? На этот вопрос, кажется, удалось ответить, когда их начали разрушать химическим способом: локальной инъекцией веществ, избирательно повреждающих только тела нейронов и не действующих на соседние волокна. Оказалось, что и в этом случае у животных развивается афагия. Дальнейшие исследования позволили обнаружить в латеральном гипоталамусе нейроны, которые активируются вкусом новой пищи, но утрачивают активность при её многократном приёме. Нейроны ещё одной разновидности возбуждаются при одном лишь виде пищи, но со временем начинают реагировать и на нейтральные стимулы, если они постоянно сопровождают еду. Это указывает на участие таких нейронов в формировании долговременной памяти, лежащей в основе образования условных рефлексов.
13.9.4. Факторы, определяющие пищевое поведение
Если попытаться суммировать результаты многочисленных и многолетних исследований вопроса о том, чем же активируется центр голода, то следует учесть все известные сигналы, на которые он может реагировать (Рис. 13.10).
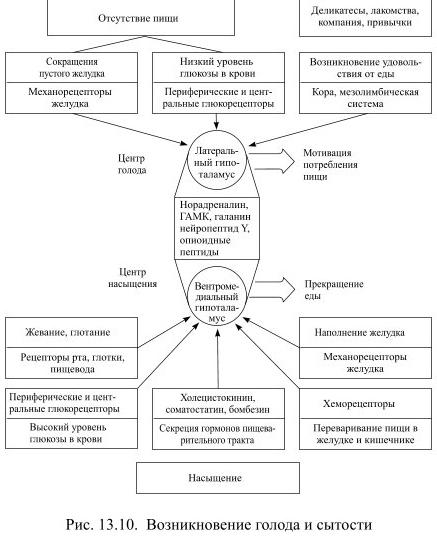
Это и прямое действие сниженного уровня сахара на нейроны латерального гипоталамуса, и поступающая к ним афферентная информация от периферических глюкорецепторов, обнаруженных в печени, желудке и тонком кишечнике. Это и афферентные сигналы от механорецепторов пустого желудка. Но это и влияния на гипоталамус других структур мозга, активированных множеством факторов, так или иначе, связанных с приёмом пищи (особый вкус, запах, внешний вид, сервировка стола, привычное время, наличие компании и т.д.). Мы ещё вернёмся к этому вопросу при обсуждении долговременной регуляции пищевого поведения липостатическим механизмом.
Что приводит к активации центра насыщения? Во-первых, жевание и глотание пищи – информация об этом поступает от вкусовых и температурных рецепторов рта, от мышечных механорецепторов. Даже при мнимом кормлении, когда проглатываемая пища не попадает в желудок (что происходит после оперативного выведения пищевода наружу), животные не едят беспрерывно, если им предоставлена возможность брать пищу без ограничений. Во-вторых, растяжение пищей желудка и соответствующая стимуляция механорецепторов. В-третьих, действие образующихся при расщеплении пищи продуктов на хеморецепторы, находящиеся в тонком кишечнике. В-четвёртых, повышение уровня сахара в крови, оказывающее прямое влияние на нейроны гипоталамуса. В-пятых, попадающие в кровь местные гормоны желудочно-кишечного тракта, такие, как холецистокинин, бомбезин, соматостатин и т.п.: известно, что их введение голодным крысам уменьшает потребление пищи.
Однако, несмотря на существование такого количества ограничителей приёма пищи, немногие люди способны отказаться от предложенного высококалорийного лакомства, даже если они совершенно не испытывают голода. Так поступают не только люди: в одном из экспериментов крысам сразу после обычного кормления, когда животные насыщались и прекращали есть корм, давали хлеб или шоколад – от этих продуктов крысы не отказывались. Опыт продолжался 120 дней, в течение которых подопытные крысы потребляли примерно на 84% больше калорий, чем при обычном питании. В результате за время эксперимента их вес увеличился на 49%. В развитых странах процент людей, имеющих избыточный вес, очень высок, в США, например, среди взрослых излишний вес имеет каждый третий, а около 12% населения просто страдают от ожирения. Как это увязывается с представлением о заданном значении веса и липостатическом механизме его регуляции?
В 1994 году было обнаружено, что при увеличенном образовании жира в жировой ткани образуется лептин – гормон, уменьшающий активность центра голода в латеральном гипоталамусе и таким путём снижающий потребление пищи. Количество образующегося лептина регулируется с помощью обратной связи: если вводить его в организм, то жировая ткань уменьшит образование собственного гормона. Тогда возникло предположение, что ожирение может быть следствием дефектов системы лептиновой регуляции, связанных с нарушениями образования лептина или снижением чувствительности к нему нейронов гипоталамуса. Однако проверка этой гипотезы показала, что лептиновая система у тучных людей не нарушена.
А как влияет изобилие доступной пищи на образование лептина? В одном из экспериментов лептин вводили двум группам крыс, отличавшихся характером питания в течение трёх дней до введения гормона. Крысам одной группы давали столько еды, сколько они могли съесть, крысы второй группы получали половину от этого количества, т.е. оказывались на полуголодном пайке. Выяснилось, что введение лептина полуголодным крысам не влияет на образование гормона в жировой ткани: он продолжает там вырабатываться, а значит, их лептиновая система не зависит от внешних воздействий, а их аппетит не повышается. При пищевом изобилии крысы реагируют на введение лептина понижением образования собственного гормона. Их лептиновая система становится чувствительной к внешним факторам, и соответственно их аппетит поддаётся стимулированию. Другими словами, у тощих крыс аппетит оказывается меньшим по сравнению с толстыми, а это означает, что лептиновая система успевает приспособиться к новым условиям всего за три дня переедания.
В силу каких причин такая перестройка может произойти у человека? Ответить на этот вопрос можно, пожалуй, с помощью всего лишь одной цитаты: "Блины были такие великолепные, что выразить вам не могу, милостивый государь: пухленькие, рыхленькие, румяненькие. Возьмёшь один, чёрт его знает, обмакнёшь его в горячее масло, съешь – другой сам в рот лезет. Деталями, орнаментами и комментариями были: сметана, свежая икра, сёмга, тёртый сыр. Вин и водок целое море. После блинов осетровую уху ели, а после ухи куропаток с подливкой. Так укомплектовались, что папаша мой тайком расстегнул пуговки на животе…" (А. П. Чехов).
Можно ли утверждать, что люди только тогда садятся к столу, когда у них снижается уровень сахара в крови? Конечно, нет. В любом здоровом организме всегда достаточно энергетических запасов и есть механизмы саморегуляции, которые могут эти запасы мобилизовать для поддержания необходимого уровня глюкозы. Непрерывное наблюдение за уровнем сахара в крови крыс, осуществляемое с помощью постоянного внутривенного катетера, показало, что он отклоняется от среднего значения не более, чем на 1-2%. Но, если кормить крыс всегда в одно и то же время, то примерно за 10 минут до подачи еды уровень сахара снижается примерно на 8%. Такого снижения нет, если дать крысам еду неожиданно, в неурочное время. Оказалось, что причиной снижения уровня сахара перед ожидаемой едой является повышение секреции инсулина, что можно рассматривать, как реакцию на намерение принять пищу. Примечательно, что если ожидаемая пища не поступит, секреция инсулина, и уровень сахара вскоре вернутся к обычному среднему значению.
Таким образом, есть механизмы гомеостатического регулирования, способные сохранять постоянное значение сахара, а возможно и аминокислот, при разных пищевых рационах и разных моделях питания, от которых непосредственно зависит количество образующегося жира и масса тела. Заданный вес может меняться под влиянием меняющейся структуры питания и устанавливаться на новом уровне. В таких случаях со временем опять устанавливается баланс между энерготратами и количеством поступающих питательных веществ, но уже при новом заданном значении.
13.10. Питьевое поведение
13.10.1. Обмен воды и солей в организме
Вода в живых организмах является основным растворителем, в котором происходит большинство химических реакций. С помощью воды транспортируются питательные вещества, продукты обмена, молекулы физиологических регуляторов, она необходима для пищеварения в кишечнике, для регуляции температуры тела и для удаления отходов жизнедеятельности. У растений вода составляет до 90% их массы, у человеческого эмбриона – 93-95%, у новорождённого – 75% от веса тела. С возрастом содержание воды в организме уменьшается и составляет у взрослых людей около 60% (у худых – 70%, а у тучных – 50%, поскольку жировая ткань бедна водой). За сутки взрослый человек с массой тела 70 кг теряет около 2,3 л воды: 1400 мл с мочой, 800 мл испаряется с поверхности кожи и уходит в виде водяных паров при дыхании, 100 мл – с калом. В то же время около 1 л воды поступает в организм с выпитыми жидкостями, примерно столько же содержится в съеденной пище и около 300 мл воды образуется при окислительных процессах в тканях – в сумме те же 2,3 л.
Приведённые цифры достаточно условны, они могут изменяться в зависимости от окружающей температуры (жаркое лето или холодная зима, регулярное посещение бани и т.п.), характера питания (например, овощи и фрукты содержат много воды, а в белковой пище её меньше), физических нагрузок (увеличенные потери воды с потом) и индивидуальных привычек, связанных с потреблением жидкостей. Но при любом варианте механизмы гомеостатического регулирования у здорового человека поддерживают баланс между потреблением и потерей воды. При уменьшении оптимального количества воды в организме (которое можно рассматривать в качестве заданного значения) возникает жажда. Она появляется, если потеря воды составит примерно 0,5% от массы тела (например, при весе 70 кг ощущение жажды вызывает потеря всего лишь 350 мл жидкости). Утрата 10% от веса тела за счёт воды приводит к тяжёлой дегидратации (обезвоживанию), а потеря 20% является смертельной (10% = 7 л, которые теряются в норме за 2, 5 суток).
Обмен воды неразрывно связан с обменом солей, а поэтому, говоря о воде, следует обсуждать проблему водно-солевого баланса. Растворённые в воде соли, в первую очередь натрия, создают осмотическое давление, которое заставляет воду перемещаться в область их большей концентрации. В организме вода распределена в трёх жидкостных пространствах: внутриклеточном, где содержится 2/3 всей воды, межклеточном или интерстициальном – приблизительно 1/4, а остальные 7-8% воды приходятся на плазму крови, лимфу и ликвор. Более высокая концентрация натрия во внеклеточной жидкости и крови, по сравнению с внутриклеточной, создаёт большее осмотическое давление. Оно уравновешивается онкотическим давлением в клетках, создаваемым растворёнными там белковыми молекулами. Таким образом, все жидкости оказываются изотоничными относительно друг друга.
Если концентрация натрия в крови и внеклеточной жидкости повысится, эти жидкости становятся гипертоничными (например, за счёт поступления большого количества соли с пищей или в связи с большой потерей воды при интенсивном потении). В таком случае вода начнёт перемещаться в область большей осмотической концентрации, т.е. из клеток во внеклеточное пространство. Потеря воды клетками (клеточная дегидратация), разумеется, крайне нежелательна, а устранить её можно, лишь восстановив прежнее, т.е. изотоничное состояние внеклеточной жидкости, – для этого надо просто разбавить её водой. Часть воды для этого можно сэкономить на диурезе, уменьшив на время объём выделяемой мочи, но одновременно необходимо увеличить количество выпиваемой жидкости.
13.10.2. Регуляция водно-солевого равновесия и питьевого поведения
Контроль величины осмотического давления осуществляют центральные и периферические осморецепторы. Функцию центральных рецепторов выполняют определённые нейроны супраоптических ядер гипоталамуса, периферические рецепторы находятся преимущественно в печени и воротной вене, несущей к печени кровь от пищеварительного тракта. Информация от периферических осморецепторов поступает к супраоптическим и паравентрикулярным ядрам гипоталамуса. При повышении осмотического давления нейроны гипоталамуса увеличивают секрецию вазопрессина, который называют также антидиуретическим гормоном (АДГ). В задней доле гипофиза, где оканчиваются аксоны этих нейронов, выделяющийся АДГ поступает в кровь и доставляется ею к почкам.
Структурными и функциональными единицами почек являются нефроны (в каждой почке содержится около 1 миллиона нефронов), образованные клубочком кровеносных капилляров, окружённым специальной капсулой, которая соединена с канальцами (См. рис.12.3). Из капилляров в капсулу фильтруется плазма крови (за исключением лишь содержащихся в ней белков), объём этого фильтрата составляет около 170-180 л/сутки у взрослого человека. В канальцах нефрона большая часть фильтрата, в котором содержатся нужные организму вещества, всасывается обратно (реабсорбируется свыше 99% фильтрата) и попадает в сеть кровеносных капилляров. В остающемся объёме, т.е. в конечной моче, содержатся ненужные продукты обмена, растворённые в воде. Моча собирается в почечные лоханки, затем по мочеточникам попадает в мочевой пузырь, откуда периодически выводится из организма. АДГ увеличивает реабсорбцию воды в канальцах нефрона, поэтому при повышенном выделении этого гормона меньше воды теряется с мочой, а диурез, естественно, уменьшается.
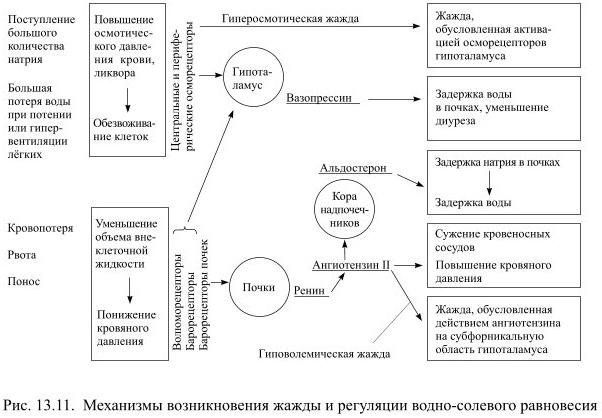
Повышение осмотического давления является главным, но не единственным стимулом для образования АДГ. Гипоталамус увеличивает образование этого гормона в ответ на афферентную импульсацию от болевых рецепторов и от волюморецепторов (рецепторов объёма) предсердий, если они меньше обычного наполняются кровью (например, вследствие её потери). Кроме того, образование АДГ стимулирует ангиотензин.
При уменьшении объёма внеклеточной жидкости и крови тоже возникает жажда, даже если осмотическое давление при этом не изменилось. Именно такая ситуация возникает после кровопотери, в том числе и у добровольных доноров. При уменьшении объёма циркулирующей крови меняется характер импульсации от волюморецепторов предсердий, а при падении кровяного давления ещё и от барорецепторов аорты и сонных артерий. Афферентная информация от этих рецепторов поступает в гипоталамус и стимулирует образование АДГ. Последующая задержка воды в почках способствует частичному восстановлению прежнего объёма внеклеточной жидкости.
Уменьшение объёма крови приводит к резкому снижению кровоснабжения почек, которые обычно получают около 20% минутного объёма кровотока. В ответ на уменьшение кровотока почки выделяют в кровь ренин, а он, действуя как фермент на содержащийся в крови белок ангиотензиноген, способствует образованию из него ангиотензина. Появление ангиотензина сопровождается тремя важными последствиями: 1) он оказывает мощное сосудосуживающее действие, что исключительно важно при потере крови; 2) стимулирует образование АДГ в гипоталамусе и одновременно способствует появлению жажды; 3) повышает секрецию альдостерона корой надпочечников. Образующийся альдостерон увеличивает задержку ионов натрия в почках, а вслед за ионами натрия, подчиняясь механизму осмоса, задерживается вода, которая обычно следует за натрием, как нитка за иглой.
Конечно же, с помощью одних лишь механизмов гомеостатического регулирования восстановить потерянный объём жидкости, как и нарушенное осмотическое равновесие, невозможно без увеличения количества потребляемой жидкости. И нарушенное осмотическое равновесие, и уменьшение объёма внеклеточной воды вызывают жажду, которую в первом случае можно назвать гиперосмотической, а во втором – гиповолемической, но в обоих случаях питьевая мотивация возникает в связи с повышением активности нейронов гипоталамуса (Рис. 13.11).
Меньше известно о том, какие физиологические механизмы способствуют окончанию питья. Несомненно, что главными из них являются восстановление осмотического равновесия и/или потерянного объёма жидкости, но, по-видимому, не только они. Имеет значение и уменьшение сухости во рту, которую вызывало пониженное слюноотделение – неизбежное следствие экономии воды. Некоторое значение имеет само питьё, т.е. связанная с ним моторная деятельность и сенсорные ощущения. Определённую роль играет соответствующая сенсорная информация от рецепторов желудка и двенадцатиперстной кишки.
Многие люди, а может быть и большинство, склонны пить, ещё до того, как возникнет жажда: именно по этой причине питьё может просто сопровождать еду. Интересно, что в таком случае количество потребляемой жидкости зачастую пропорционально степени солёности пищи, т.е. на основе своего опыта человек может научиться предупреждать сдвиг водно-солевого равновесия. Количество выпиваемой жидкости нередко существенно зависит от её вкуса, от существующей традиции потребления определённых напитков (чай, квас, пиво и т.п.).
13.11. Половое поведение
13.11.1. Критические периоды половой дифференцировки
Половые мотивации обусловлены, в первую очередь, действием половых гормонов на определённые структуры мозга. Но, как соотношение андрогенов и эстрогенов, так и функция (и даже структура) некоторых областей мозга у женщин и мужчин существенно отличаются. Эти отличия появляются впервые на седьмой неделе внутриутробного развития, когда определяется программа развития гонад: яичников у женщин, яичек у мужчин. До этого времени у зародышей, имеющих разный генетический пол (ХХ – будущие женщины и ХY – будущие мужчины) нет никаких биологических различий. Если во время этого периода, являющегося критическим, не появится специфический белок, синтез которого контролирует Y-хромосома, то дальнейшее развитие всегда происходит по пути формирования женского организма – для этого не требуется никакого дополнительного влияния, такой путь является стандартным.
В коротком плече Y-хромосомы содержится ген, кодирующий белок, который вызывает формирование яичек. Если блокировать действие этого белка у эмбриона экспериментального животного с генотипом XY, то разовьётся женский организм. И наоборот: введение такого белка генетически женскому эмбриону в критическом периоде приведёт к образованию мужского фенотипа. Таким образом, всё дальнейшее развитие по женскому или мужскому варианту определяет один ген Y-хромосомы.
Следующий критический период относится к третьему месяцу внутриутробного развития, когда у мужского плода уже сформируются яички и в них начинает вырабатываться тестостерон, а также гликопротеин, вызывающий разрушение клеток т.н. мюллерова протока – эмбриональной структуры, из которой формируются женские половые органы. Тестостерон в это же время способствует развитию вольфова протока, из которого формируются мужские половые органы. У женского плода тестостерона нет, а при его отсутствии всё происходит наоборот: из мюллерова протока развиваются женские половые органы, а клетки вольфова протока постепенно погибают, причём для этих процессов женские половые гормоны – эстрогены не требуются, а образующиеся яичники в это время ещё не выделяют гормоны. Если удалить яичники у женского плода экспериментального животного, то всё равно рождается особь женского пола.
Развитие мужского плода наряду с тестостероном могут определять материнские гормоны – эстрогены, которые попадают в его организм через плаценту. Все эти гормоны вызывают развитие мозга по мужскому типу, т.е. маскулинизируют его. Почему мужские и женские гормоны обладают одинаковым действием? Их молекулы, образующиеся из общего предшественника – холестерина, очень похожи и тестостерон в клетках-мишенях, где обычно есть специальный фермент, легко превращается в эстрадиол путём ароматизации бензольного кольца, а именно эстрадиол оказывает непосредственное маскулинизирующее действие. От материнских эстрогенов плоды обоего пола защищаются с помощью специального белка – a-фетопротеина, который специфически связывает эстрогены.
У мужского плода тестостерон проникает в клетки мозга (прежде всего гипоталамуса, а также миндалин, среднего мозга, спинного мозга, коры – особенно лимбической), где путём ароматизации превращается в эстрадиол, который и вызывает маскулинизирующий эффект. В чём состоит этот эффект? Он, прежде всего, выражается в том, что у взрослых мужчин и женщин секреция гонадотропных гормонов гипофиза происходит по-разному: у мужчин они выделяются равномерно, а у женщин – циклически, в зависимости от созревания фолликулов в яичниках. Это определяется различной чувствительностью гипоталамических нейронов, секретирующих гонадолиберины для гипофиза, к действию половых гормонов, и такие различия появляются ещё до рождения. Кроме того, маскулинизирующий эффект проявляется в более агрессивном поведении представителей мужского пола. Если вводить беременным самкам мышей тестостерон, то даже рождающиеся от такой беременности самки более агрессивны, чем обычно, в определённой мере изменяется и их половое поведение.
Ещё одна критическая фаза, определяющая появление половых различий мозга, приходится на т.н. перинатальный период – небольшой временной промежуток до и после рождения. Наличие или отсутствие тестостерона в этом периоде существенно сказывается на развитии полового диморфизма (существования двух различных форм у одного вида) мозга. Кроме уже указанных различий в характере секреции гонадотропных гормонов гипофиза и гонадолиберинов гипоталамуса, половой диморфизм проявляется в структуре определённых нейронов. У представителей разного пола нейроны преоптической области гипоталамуса и вентромедиального ядра имеют разную форму дендритов и самого ядра, что предопределяет различия в характере обработки афферентной информации. Электрическая стимуляция преоптической области у самцов многих видов животных немедленно стимулирует половую активность, а её разрушение приводит к угнетению полового поведения. У самок аналогичные изменения наблюдаются при стимуляции или разрушении вентромедиального ядра гипоталамуса.
У всех млекопитающих, в том числе и у человека, в преоптическом регионе гипоталамуса есть небольшое ядро, получившее название полодиморфного. Сразу после рождения в нём незаметны различия, связанные с полом, но довольно скоро выявляется почти в два раза большая величина его и большее содержание клеток у представителей мужского пола (Рис. 13.12).
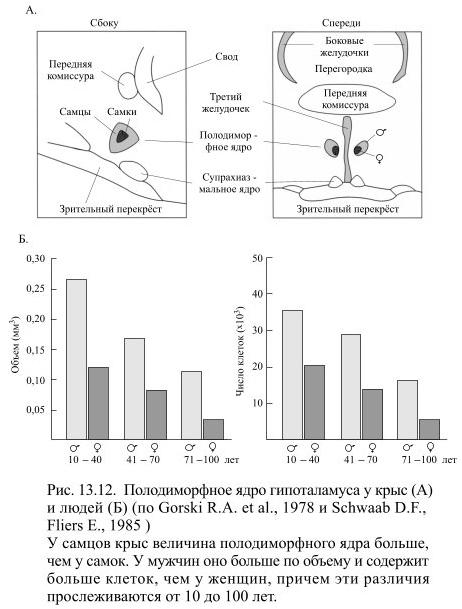
Эти различия сохраняются до глубокой старости, хотя примерно после 40 лет величина ядра и у мужчин, и у женщин уменьшается. Этот вопрос изучался экспериментально путём наблюдения за развитием мышей, кастрированных сразу после рождения. Оказалось, что это у таких животных полодиморфное ядро с возрастом не увеличивается, но, если сразу после кастрации вводить им тестостерон, оно сможет развиваться как у интактных мышей.
Есть факты, свидетельствующие о том, что тестостерон способствует половой дифференцировке спинного мозга. В его крестцовом отделе у самцов крыс была выделена небольшая группа мотонейронов, управляющая двумя мышцами, связанными с половым членом. У взрослых самок таких мышц нет, так же, как и соответствующих мотонейронов. Но, если новорождённым самкам вводить в спинной мозг тестостерон, то можно замедлить постепенное отмирание этих мотонейронов.
Секреция тестостерона у зародыша мужского пола начинается примерно на седьмой неделе беременности и вскоре достигает высокого уровня – это первый критический период. На поздних сроках беременности содержание тестостерона в плазме крови плода становится низким, но сразу после рождения, т.е. в перинатальном периоде, быстро повышается – это второй критический период. К концу первого года жизни секреция тестостерона снова сильно уменьшается и остаётся на низком уровне до наступления пубертатного периода или периода полового созревания. Он начинается у мальчиков приблизительно с 12, а у девочек – с 11 лет, когда половые железы увеличивают секрецию гормонов. К 17-16 годам секреция гормонов достигает уровня, характерного для взрослых. До пубертатного периода, при низкой секреции половых гормонов мальчики и девочки мало различаются, а с началом этого периода формируются присущие каждому полу вторичные половые признаки: особенности роста волос и структуры кожи, характер формирования жировой ткани, развитие мышечной массы и грудных желёз, тембр голоса и т.п. И у мальчиков, и у девочек образуются как мужские половые гормоны (андрогены), так и женские (эстрогены), но у мальчиков преобладает первая группа гормонов, а у девочек – вторая: соотношение этих гормонов определяет индивидуальный тип маскулинизации или феминизации. Многие учёные склонны связывать проявления агрессивности в поведении с уровнем тестостерона, эта гипотеза кажется убедительной, если сравнить в среднем поведение мужчин и женщин.
13.11.2. Половые особенности когнитивной деятельности
Если вторичные половые признаки легко различимы, то связанные с полом особенности когнитивной деятельности далеко не так бросаются в глаза, тем не менее, они существуют. В экспериментах, проведённых на обезьянах разного возраста и пола, было показано, что повреждение префронтальной коры у молодых самцов приводит к таким же нарушениям пространственного различения, что и взрослых животных обоего пола. Повреждение этой же области коры у молодых самок такими нарушениями не сопровождается. Вместе с тем известно, что взрослые самцы превосходят самок в способности пространственного различения (так же, как и мужчины справляются с подобными задачами в среднем лучше, чем женщины). Найденные различия принято объяснять более ранним созреванием префронтальной коры у представителей мужского пола.
Ещё одна сторона деятельности мозга, в которой обнаружены зависящие от пола отличия, связана с функциональной асимметрией больших полушарий. У большинства правшей левое полушарие в большей степени осуществляет речевую функцию, а правое лучше справляется с пространственными представлениями, например, мысленным вращением какого-либо предмета. Именно поэтому представление о форме предмета, который нельзя увидеть, но можно потрогать, складывается легче, если ощупывать его левой рукой: в таком случае легче и определить, какой из изображённых на картинке предметов был предъявлен для опознания. Большинство взрослых, как мужчин, так и женщин, предпочитают выполнять этот тест левой рукой. Мальчики поступают так примерно с шести лет, что указывает на уже развившуюся у них асимметрию полушарий; девочки не обнаруживают признаков асимметрии примерно до 13 лет. На более раннюю специализацию полушарий у мальчиков указывает и тот факт, что повреждение левого, т.е. речевого полушария приводит у них к большим нарушениям речи, чем у девочек того же возраста, чей мозг ещё сохраняет высокую степень пластичности. По этой же причине различные формы детской афазии (нарушения речи) и речевой дефицит чаще наблюдаются у мальчиков.
При очаговых поражениях различных полушарий мозга у взрослых мужчин наблюдается чёткая связь между стороной повреждения и нарушенной функцией: патологический очаг в левом полушарии повреждает, как правило, речевую функцию, в правом – неречевые функции. У женщин такая зависимость проявляется в меньшей степени, что указывает на менее выраженную функциональную асимметрию. В дополнение к этому следует указать на превосходство женщин в беглости речи, скорости восприятия и узнавания некоторых объектов, например, человеческих лиц, в способности проводить арифметические вычисления. Мужчины в среднем превосходят женщин в способности формировать пространственные представления, логически мыслить и программировать целенаправленную моторную деятельность.
13.11.3. Биологические основы сексуального поведения
Мужское сексуальное поведение в значительной мере определяет тестостерон, действующий на специальные нейроны гипоталамуса. После кастрации сексуальный интерес уменьшается быстро и сильно. В 1959 году Бремер (Bremer J.) опубликовал результаты наблюдений 157 случаев кастрации, в половине из них уже в ближайшие недели наблюдалась полная асексуальность, у большинства остальных подвергнутых операции мужчин быстро исчезала способность к эрекции полового члена, хотя сексуальный интерес сохранялся. Параллельно с этим изменялись вторичные половые признаки: уменьшилось количество волос на лице, туловище, руках и ногах; кожа стала мягче, а мышечная сила уменьшилась. Лишь в отдельных случаях на протяжении нескольких месяцев сохранялась сексуальная активность, что, по-видимому, объяснялось действием андрогенов надпочечников.
С помощью инъекций тестостерона можно восстановить сексуальное поведение после кастрации. Первое доказательство такого рода было получено ещё в начале 20-х годов ХХ столетия, когда за медицинской помощью обратился 38-летний ветеран Первой мировой войны, у которого яички отсутствовали в результате осколочного ранения. Его половая дееспособность была восстановлена с помощью повторных введений тестостерона, хотя, разумеется, это не избавило пациента от бесплодия (ввиду отсутствия органа, в котором образуются гаметы).
Уровень тестостерона в крови не определяет, однако, степень половой потенции: для неё необходим лишь определённый минимальный уровень гормона, а в какой мере он превышен у того или иного мужчины – особой роли не играет. Известен эксперимент, в котором были кастрированы самцы морских свинок, предварительно разделённые на три группы (сильных, средних и слабых) в соответствии со своим половым поведением. После кастрации все животные стали асексуальными и тогда им начали вводить тестостерон в больших дозах, одинаковых во всех трёх подопытных группах. Половая потенция восстановилась, причём её проявления у животных трёх наблюдаемых групп оказались такими же разными, как и до операции, т.е. их также можно было разделить на сильных, средних и слабых, хотя уровень тестостерона у всех был одинаково высоким. Следовательно, индивидуальные отличия полового поведения определяются какими-то другими факторами, данные о физиологических механизмах которых пока отсутствуют.
Сексуальное поведение самок у многих видов грызунов в значительной степени зависит от уровня эстрогена и прогестерона, который циклически меняется. Именно этим объясняется то обстоятельство, что самки многих видов млекопитающих сексуально активны только в определённые периоды эстрального цикла. Сексуальное поведение женщин не связано в такой же мере с менструальным циклом и, скорее всего, управляется иначе. Неожиданно малое влияние на него оказывает даже оперативное удаление яичников. Существует предположение, что половое поведение женщин зависит не столько от эстрогенов, сколько от андрогенов надпочечников. Эта гипотеза основана на экспериментальных доказательствах, а также на установленных фактах корреляции половой активности женщин с уровнем андрогенов, но не эстрадиола. Кроме того, у женщин, перенесших хирургическую операцию одновременного удаления яичников и матки (что обычно тяжело переносится не только физически, но и психологически) восстановить половую мотивацию удаётся с помощью инъекций тестостерона, но не эстрадиола.
Резюме
Изменения гомеостатических параметров приводят в действие нервные и эндокринные механизмы их регуляции, направленные на восстановление заданного значения параметров. Одновременно с этим или заблаговременно формируется специфическое поведение, направленное на достижение той же цели. Главной мотивационной структурой мозга является гипоталамус, нейроны которого активируются притоком специфических афферентных импульсов и прямым влиянием гуморальных факторов. В мотивациях, связанных с действием внешних факторов важную роль играют миндалины мозга. Конкретные формы мотивированного поведения и определения мотивационной доминанты определяются сложными разновидностями взаимодействия между подкорковыми структурами и корой мозга, причём важную роль играет прежний поведенческий опыт и образованные следы памяти.
Вопросы для самоконтроля
205. Какая из указанных ниже структур не относится к мезолимбической системе?
А. Красное ядро; Б. Прилегающее ядро; В. Обонятельная луковица; Г. Перегородка; Д. Префронтальная кора.
206. С выделением какого нейромедиатора в прилегающем ядре связано получение удовольствия, как "награды" за совершённые действия?
А. Глутамат; Б. ГАМК; В. Глицин; Г. Дофамин; Д. Серотонин.
207. Какая структура мозга играет главную роль в формировании поведения, мотивированного, в первую очередь, внешними факторами?
А. Гипоталамус; Б. Таламус; В. Миндалина; Г. Гипофиз; Д. Гиппокамп.
208. Из какого источника миндалины мозга получают необходимую афферентную информацию раньше всего?
А. Таламус; Б. Гипоталамус; В. Орбитофронтальная кора; Г. Поясная извилина; Д. Вторичная слуховая кора.
209. Какая из перечисленных структур должна активироваться прежде других при изменениях гомеостаза и формировании биологических мотиваций?
А. Гипоталамус; Б. Гиппокамп; В. Лобная кора; Г. Височная кора; Д. Миндалины.
210. В чём состоит терморегулирующая роль переднего гипоталамуса?
А. Суммация температурных сигналов; Б. Регуляция интенсивности конвекции; В. Регуляция интенсивности теплоизлучения; Г. Регуляция потоотделения; Д. Регуляция теплопроведения.
211. В какой области нет термочувствительных нейронов?
А. Кожа; Б. Внутренние органы; В. Спинной мозг; Г. Передний гипоталамус; Д. Задний гипоталамус
212.. Какой из перечисленных ниже гормонов не относится к контринсулярным?
А. Глюкагон; Б. Тироксин; В. Соматотропин; Г. Адреналин; Д. Кортизол.
213. Какие клетки используют находящуюся в крови глюкозу без помощи инсулина?
А. Клетки печени; Б. Нервные клетки; В. Клетки соединительной ткани; Г. Клетки скелетных мышц; Д. Любые клетки получают глюкозу только при посредничестве инсулина.
214. Какой гормон способствует образованию жировой ткани?
А. Инсулин; Б. Глюкагон; В. Адреналин; Г. Соматотропин; Д. Кортизол.
215. Разрушение какого отдела гипоталамуса сопровождается афагией?
А. Вентромедиальный; Б. Латеральный; В. Передний; Г. Задний; Д. Паравентрикулярные ядра.
216. Что из перечисленного ниже является самым сильным активатором центра голода в гипоталамусе?
А. Жевание и глотание пищи; Б. Гипогликемия; В. Стимуляция механорецепторов растянутого желудка; Г. Действие гормонов желудочно-кишечного тракта на гипоталамус; Д. Действие продуктов расщепления пищи на хеморецепторы тонкого кишечника.
217. Какое вещество уменьшает активность центра голода в гипоталамусе?
А. Галанин; Б. Норадреналин; В. Нейропептид Y; Г. Лептин; Д. ГАМК.
218. При каком уменьшении процентного содержания воды от заданного значения с наибольшей вероятностью можно предсказать появление жажды?
А. 0,1%; Б. 0,2%; В. 0,3%; Г. 0,4%; Д. 0,5%.
219. Что может привести к нормализации повышенного осмотического давления крови?
А. Повышенное образование ренина; Б. Повышенное образование альдостерона; В. Повышенное образование вазопрессина; Г. Повышенный водный диурез; Д. Уменьшенное потребление воды.
220. В каком периоде развития определяется формирование мужского или женского фенотипа при генотипе XY?
А. В момент оплодотворения яйцеклетки, т.е. возникновения генотипа XY; Б. На седьмой неделе внутриутробного развития; В. На третьем месяце внутриутробного развития; Г. В перинатальном периоде; Д. В пубертатном периоде.
221. Под действием какого гормона в процессе внутриутробного развития формируется женский фенотип при генотипе ХХ?
А. Тестостерон; Б. Эстрадиол; В. Прогестерон; Г. Фоллитропин; Д. Этот процесс не зависит от гормонов.
222. Чем определяется половой диморфизм в характере секреции гонадотропных гормонов гипофиза?
А. Генотипом ХХ или ХY; Б. Действием материнских гормонов на развивающийся плод; В. Собственным a-фетопротеином плода; Г. Действием тестостерона; Д. Действием эстрадиола.
223. Что из перечисленного ниже не относится к вторичным половым признакам?
А. Особенности роста волос; Б. Структурные особенности кожи; В. Тип гамет; Г. Характер развития мышечной массы; Д. Характер развития грудных желёз.
224. В каком виде когнитивной деятельности мужчины в среднем превосходят женщин?
А. В беглости речи; Б. В скорости восприятия некоторых объектов; В. В арифметическом счёте; Г. В формировании пространственных представлений; Д. В узнавании человеческих лиц.
225. С действием какого из перечисленных гормонов связывают сексуальную активность женщин?
А. Гонадотропные гормоны гипофиза; Б. Андрогены надпочечников; В. Эстрадиол; Г. Прогестерон; Д. Суммарная активность эстрогенов.
| Назад | Оглавление | Далее |