Медицинская реабилитация
Глава VI. Общие принципы трепанации черепа
Хирургическая обработка ран мягких тканей головы
При наличии ран мягких тканей головы операцию начинают с подготовки операционного поля. Вокруг раны производится сбривание волос. Рана обильно промывается 3 % раствором перекиси водорода для удаления мелких инородных тел, волос и т.д.
Края раны осторожно обрабатываются антисептиком. Антисептический раствор не должен попадать в саму рану. Края раны затем инфильтруют раствором антибиотика, допустимым к эндолюмбальному введению (пенициллина натриевая соль, канамицин), на 0,5 %-ном новокаине. Этим достигается и местная анестезия, и профилактика развития раневой инфекции.
Вкол иглы следует производить рядом с краем раны герез кожу, но не герез саму раневую поверхность (рис. 39).
Вкол иглы через раневую поверхность способствует заносу инфекции вглубь неповрежденных тканей и провоцирует развитие нагноения в послеоперационном периоде.

Рис. 39. Место вкола иглы при первичной хирургической обработке раны мягких тканей головы:
а – через неповрежденную ткань (правильно); б – через край раны (неправильно)
Иссечение краев раны производится с учетом расположения артериальных стволов таким образом, чтобы в разрезы их попало как можно меньше. Иссечение должно быть экономным и выполняться так, чтобы после зашивания раны подлежащие ткани (кость, ТМО) были бы обязательно прикрыты мягкими тканями. В тех случаях, когда в силу обширных дефектов мягких тканей или избыточного иссечения их при ПХО кость остается неприкрытой, существует опасность некроза, инфицирования и остеомиелита кости. Если все же не удается прикрыть обнаженную кость из-за недостатка мягких тканей, то поступают следующим образом. На участке кости, который не удается укрыть, коловоротом, снабженным копьем, производится удаление наружной компактной пластинки до диплоического слоя. Желательным является условие формирования практически сплошной площадки со снятой наружной пластинки. Этим создаются условия для нарастания грануляционной ткани и последующего благоприятного приживления кожных трансплантатов. Правила зашивания ран мягких тканей головы изложены в конце главы.
Методика трепанации черепа
1. Убедиться в правильности выбора стороны вмешательства.
2. Фиксировать голову в нужном положении для удобства доступа путем подкладывания под голову резинового или ватно-марлевого кольца или путем применения жесткой фиксации с помощью скобы Mayfield-Kees.
Это создает надежность и сводит к минимуму риск дислокации эндотрахеальной трубки.
3. Правильно выбрать физиологическое положение больного на операционном столе (наиболее часто это положение на спине с валиком под плечом и на боку). При положении на боку для профилактики позиционной компрессии аксиллярных сосудисто-нервных образований необходимо под грудную клетку, чуть ниже подмышечной впадины, подложить валик.
4. Необходимо следить за исключением возможного контакта тела больного и металлических частей стола.
5. Голова должна быть чисто выбрита и вымыта, причем предпочтительнее за несколько минут до начала операции.
6. Обработать операционное поле большим количеством антисептика, согласно инструкции по его применению.
7. Правильно выбрать тип и расположение разреза.
Техника краниотомии
Перед обкладыванием бельем операционного поля целесообразно наметить линию разреза раствором бриллиантовой зелени. Разрез мягких тканей производится подковообразный или линейный вертикальный. При этом следует учитывать расположение и тип ветвления поверхностной височной артерии. Пересечение ее, особенно при магистральном типе ветвления, может привести к некрозу мягких тканей в зоне вмешательства. Поэтому перед разметкой предполагаемого разреза следует прощупать поверхностную височную артерию. Отступив от нее влево или вправо на 2 – 3 см, наметить линию разреза. При подковообразном разрезе артерия должна располагаться в центре предполагаемого кожно-апоневротического лоскута.
Имеет ли смысл инфильтрация физиологигеским раствором мягких тканей по ходу разреза? Инфильтрация мягких тканей физиологическим раствором с целью «гидропрепаровки» или гемостаза практически ничего не дает. Если же хирург традиционно предпочитает инфильтрацию с целью гемостаза, то наиболее эффективным является применение 10 – 20 мл 2%-ного новокаина с добавлением адреналина (при отсутствии противопоказаний для его применения). Адреналин вызывает спазм артерий в области разреза примерно на 2 ч.
Форма разреза зависит от планируемого доступа и может быть как линейной, так и подковообразной (рис. 40).
Предпочтение следует отдавать подковообразным разрезам кожи с широким основанием питающей ножки. При этом обеспечивается большая площадь для трепанации и отсутствие в ране ранорасширителя. Для соблюдения лучшего косметического эффекта возможно выполнение волнообразных разрезов.
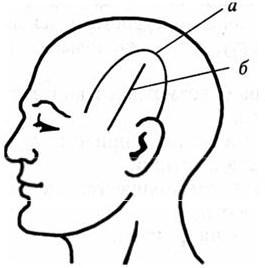
Рис. 40. Основные формы разрезов мягких тканей головы:
а – подковообразный; б – линейный
Для лучшего гемостаза при разрезе пальцы хирурга и ассистента, располагаясь перпендикулярно ране, должны плотно прижать кожу к кости. Длина «шага» при разрезе не должна превышать ширину 4 пальцев в поперечнике. При разрезе кожи следует сразу же прорезать и апоневроз. Это дает возможность развести края раны наложенной салфеткой изнутри с пальцевым сжатием краев. Наложение гемостатических зажимов лучше начинать с «ассистентской» стороны.
Важна правильная техника наложения кровоостанавливающих зажимов на края кожной раны. Зажимы следует накладывать на апоневроз, без погружения бранш на всю глубину и захвата подкожной жировой клетгатки (рис. 41). Достаточно 3 – 5 мм захвата апоневроза. Наложение зажима на всю толщу отсепарованного лоскута (включая и кожу) приводит к расплющиванию мягких тканей и их некрозу в послеоперационном периоде. Не должно быть самоделью наложение зажимов во всех местах, где видны кровоточащие артерии, хотя и желательно накладывать их именно в этом месте. Зажимы накладывают примерно через 1,5 – 2 см в зависимости от степени кровоснабжения разрезанного участка. На мягких тканях при откидывании зажимов в стороны происходит вытяжение апоневроза и его перегиб через кожный край, что обеспечивает хороший гемостаз вдоль всей линии разреза (рис. 42). Образовавшуюся рану следует тампонировать сухой салфеткой.
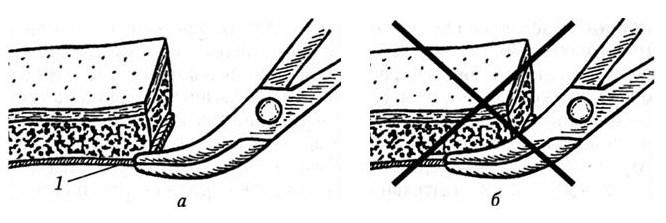
Рис. 41. Техника наложения зажима на апоневроз:
а – правильная: 1 – апоневроз; б – неправильная (по Ю. В. Кушелю, В. Е. Семину, 1998)
После формирования кожно-апоневротического лоскута его следует отвернуть к основанию, при этом обязательно подложив под него валик из салфеток. Этим достигается ббльший гемостаз и профилактика нарушения кровообращения в лоскуте из-за резкого перегиба в области питающей ножки.
Если изначально планируется выполнение резекционной трепанации черепа, надкостница рассекается параллельно краю кожного разреза (отступив от него на 1 см) при подковообразном разрезе и линейно по центру раны – при линейном доступе. После этого распатором она отслаивается либо к основанию, либо в стороны. После выбора места наложения фрезевого отверстия коловоротом, снабженным копьем, начинают сверление кости с дозирован-ным усилием во избежание проваливания в полость черепа.
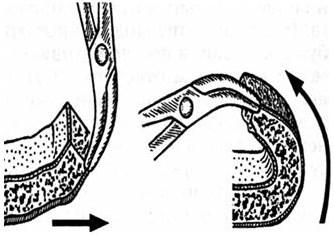
Рис. 42. Принцип действия кровоостанавливающего зажима на мягких тканях головы (по Ю. В. Кушелю, В. Е. Семину, 1998)
Сверление продолжается до внутренней стекловидной пластинки и частичного ее вскрытия. В последующем ложечкой Фолькмана производится удаление остатков lamina vitrea в проекции отверстия. Смена копья на фрезу должна происходить над столиком операционной сестры во избежание его случайного падения на пол. Целесообразно иметь наготове два стерильных коловорота. Конической или шаровой фрезой производится рассверливание фрезевого отверстия до необходимых размеров. При этом допускается выполнение угловых качательных движений во время сверления кости для увеличения размеров отверстия.
Формирование трепанационного окна при резекционном способе производится костными кусачками. Важно помнить о необходимости именно скусывания кости, а не отламывания ее кусачками от материковых участков. Несоблюдение этого правила может привести к нежелательным выламываниям крупных фрагментов кости при сопутствующих переломах костей свода черепа, а также к повреждению подлежащих структур. Края сформированного трепанационного окна должны быть по возможности округлыми, без острых выступов и «фестончатых» краев. Эти острые выступы, как во время операции, так и в послеоперационном периоде, при выбухании мозга в трепанационное окно могут ранить вещество мозга и корковые сосуды. Это приводит к дополнительной гибели нейронов и кровотечению, что может потребовать дополнительного или повторного хирургического вмешательства.
Размеры трепанационного отверстия должны быть достаточными для полноценной ревизии внутричерепных образований или удаления патологического очага. Частой ошибкой является стремление хирургов выполнить ревизию из малого трепанационного отверстия (2x3 см). Попытка ревизии из такого окна не только базальных, но и конвекситальных отделов приводит к дополнительной травме мозга. Небольшое трепанационное отверстие при незашитой ТМО и выбухании мозга в послеоперационном периоде приводит к ущемлению мозга в костном отверстии. При этом сдавливаются корковые сосуды, в первую очередь венозные, что приводит к венозному застою, гипоксии и еще большему отеку пролабированного участка мозга. Дальнейшее нарастание ущемления вызывает пережатие артериальных сосудов с последующим развитием инфаркта участка мозга.
Нежелательно также и чрезмерно большое трепанационное окно. Увеличение костного дефекта приводит к увеличению площади образования послеоперационных рубцов и сращений, риску возникновения болезни «трепанированного черепа», постгравматической эпилепсии. В зависимости от величины и локализации патологического травматического очага трепанационное окно должно быть не меньше чем 6 х 7 х 8 см.
Очень важным является правильный выбор места наложения трепанационного отверстия. При выполнении компьютерной томографии хирург имеет возможность оценить вид и локализацию травматического очага и в соответствии с этим планировать место наложения трепанационного отверстия и объем вмешательства. Врачи неспециализированных стационаров такой возможности не имеют и должны учитывать, что при ЧМТ чаще поражаются базальные и нижнеконвекситальные отделы головного мозга (полюсы лобных и височных долей). Это диктует требование наложения трепанационного отверстия как можно ниже к основанию черепа. При этом «бортик» височной кости у нижнего края трепанационного окна должен быть как можно меньше. Это позволяет произвести ревизию базальных отделов черепа и мозга и при необходимости удаление патологического очага с минимальной травмой для мозга. Гемостаз из диплоических сосудов осуществляется применением мягкого воска.
Костно-пластигеская трепанация (КПТ) черепа осуществляется традиционным способом путем наложения нескольких фрезевых отверстий и соединения их пилой Джигли или из одного отверстия при использовании краниотома. Особо внимательным хирургу следует быть при проведении проводника пилы под костью во избежание повреждения твердой мозговой оболочки и внедрения инструмента в мозг.
На современном этапе предпочтение следует отдавать технике свободного костного лоскута, при которой меньше травмируется надкостница и костный лоскут не мешает работе (так как он на время основного этапа операции удаляется из раны). Ведущие зарубежные нейрохирурги (М. G. Yasargil, J. М. Tew, Н. R. van Loveren и многие другие) считают формирование свободного костного лоскута краниотомом из одного фрезевого отверстия золотым стандартом. Декларируемый риск развития остеомиелита и плохого сращения в последующем не имеют под собой достаточных оснований. Ссылки на питающую надкостничную ножку и необходимость ее сохранения не подтверждаются морфологическими данными, которые свидетельствуют о том, что около 80 % кровоснабжения кости происходит через твердую мозговую оболочку.
Показания к рассечению твердой мозговой оболочки при непроникающей черепно-мозговой травме и техника его выполнения
Любой хирург должен помнить, что рассечение ТМО переводит ЧМТ из закрытой или открытой в проникающую. Риск развития инфекционных осложнений в послеоперационном периоде резко возрастает. Однако и необоснованный отказ от ее рассечения может привести к серьезной ошибке – нераспознанию субдуральной гематомы или массивного контузионного очага.
Предоперационные данные компьютерной томографии с верификацией патологического очага, требующего удаления, снимают данный вопрос с обсуждения. Врачам же неспециализированных стационаров приходится сложнее, и вопрос рассечения ТМО решается непосредственно в ходе вмешательства. При этом хирург ориентируется по косвенным признакам субдуральной гематомы или другого патологического процесса, требующего хирургического лечения.
Рассечение твердой мозговой оболочки показано в следующих случаях:
– если она резко напряжена;
– если она не передает пульсацию подлежащего мозга;
– если она синюшного цвета.
Твердую мозговую оболочку можно не рассекать при наличии следующих признаков:
– отсутствие ее напряжения;
– хорошая ее пульсация;
– естественный серовато-розовой цвет.
Ответственность при решении не рассекать ТМО огенъ высока. Ошибка может привести к тяжелым последствиям и неблагоприятному исходу.
Перед рассечением ТМО необходимо коагулировать ее сосуды, так как коагуляция сосудов после рассечения ТМО приводит к ее «съеживанию», что затрудняет в последующем наложение швов. Если нет возможности использовать коагуляцию, сосуды, в особенности среднюю оболочечную артерию, необходимо прошить и перевязать тонкой прочной лигатурой. Если все же кровотечение из ТМО возникло после ее рассечения, то не следует кровоточащий сосуд коагулировать. Кровотечение можно остановить раздавливанием сосуда зажимом.
Как лугше рассекать твердую мозговую обологку? В большинстве публикаций и учебников отдают предпочтение крестообразному рассечению. Действительно, при наличии прямоугольного трепанационного окна и выполнении разрезов по диагонали площадь открытого операционного поля будет соответствовать площади костного дефекта.
Как известно из практики, чаще выполняются трепанационные отверстия округлой формы.
При данном способе трепанации крестообразное рассечение ТМО приводит к образованию ромбообразного «окошка», которое примерно на 30 % меньше площади костного окна (рис. 43). Возможность обзора ревизуемых структур головного мозга становится значительно меньше.
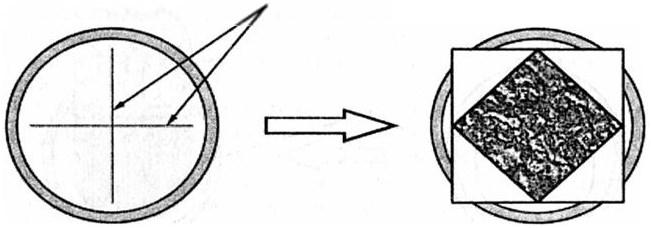
Рис. 43. Схема крестообразного рассечения твердой мозговой оболочки и создания ее операционного дефекта ромбообразной формы. Стрелками указаны линии рассечения ТМО
Более предпочтительным способом является подковообразное рассечение ТМО с формированием питающей ножки основанием к стороне вхождения питающих сосудов или синусов (рис. 44).
На рис. 45 представлена схема наиболее оптимального способа рассечения ТМО. На первом этапе, с учетом двухслойной структуры ТМО, производится подковообразное рассечение наружного листка основанием к месту вхождения питающих сосудов или синусов (рис. 45, а). Затем осторожно наружный листок ТМО отслаивается от внутреннего и откидывается к основанию (рис. 45, б). На втором этапе формируется лоскут из внутреннего листка ТМО с основанием на противоположной стороне (рис. 45, в). В результате формируется дефект ТМО прямоугольно-овальной формы (рис. 45, г).
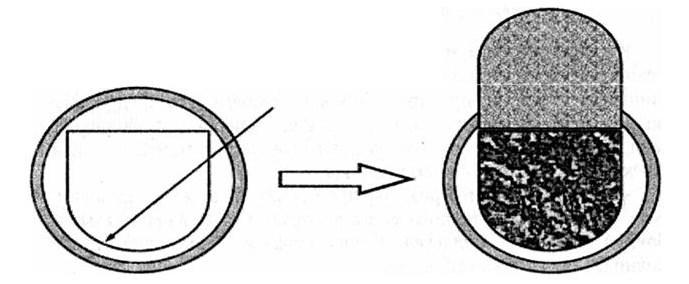
Рис. 44. Схема подковообразного рассечения твердой мозговой оболочки, дающего большую, чем при крестообразном способе, площадь обзора. Стрелкой указана линия рассечения ТМО
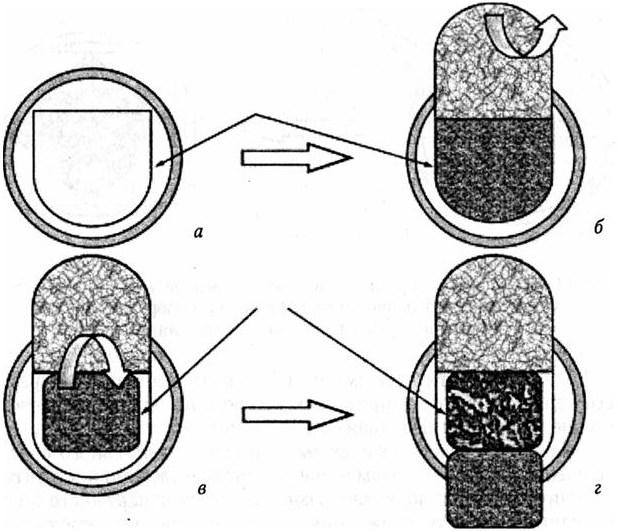
Рис. 45. Схема рассечения твердой мозговой оболочки разделенными (расщепленными) ее лоскутами:
а – линия рассечения поверхностного листка ТМО; б – отслаивание наружного листка ТМО от внутреннего; в – формирование лоскута из внутреннего листка ТМО; г – образован дефект ТМО прямоугольно-овальной формы. Стрелками указаны линии рассечения листков ТМО
К преимуществам этого способа можно отнести возможность пластического закрытия дефекта в твердой мозговой оболочке с герметичным ушиванием при пролабировании мозга. Это предупреждает возможность развития в послеоперационном периоде ликворных свищей, формирования грубых рубцов между корой головного мозга и мягкими тканями покровов головы.
Начинающие нейрохирурги с целью увеличения площади обзора коры головного мозга допускают одну из типигных ошибок, рассекая ТМО непосредственно у края костного окна. При этом возникает несколько проблем:
1. «Материковый» край ТМО «уходит» под кость, что создает значительные трудности при последующем ушивании ее или пластике, а иногда и просто невозможность выполнить данную хирургическую манипуляцию.
2. Костный край трепанационного окна остается не прикрытым участком ТМО, что при пролабировании мозга в дефект приводит к дополнительной травме коры и кровотечению из сосудов головного мозга.
Избежать этих осложнений можно, проводя линию разреза ТМО, отступив от края кости на 0,5 – 0,7 см. Этим простым приемом достигается удобство при зашивании и пластике ТМО, а также создается мягкотканный протектор между костью и мозгом при выбухании его вещества в трепанационное окно.
Зачастую после удаления субдуральных гематом при зашивании ТМО возникает выраженное кровотечение из эпидурального пространства. Данная ситуация обусловлена тем, что в конце операции внутричерепное давление уменьшается и мозг не прижимает ТМО к кости. Тампонирование эпидурального пространства большим количеством ватников, мышцей или гемостатической губкой приводит лишь к большему кровотечению. В связи с этим рекомендуется до рассечения ТМО подшить ее по периферии к кости. Если же хирург столкнулся с ситуацией кровотечения из эпидурального пространства, остановка его может быть произведена следующим способом. После вымывания и аспирационного определения источника кровотечения в эпидуральное пространство вводится небольшой кусочек раздавленной мышцы или гемостатической губки и шпателем, введенным субдурально, прижимается к кости. Четырех-пяти минут бывает достаточно для остановки кровотечения. Мышца или губка не удаляются.
Любая нейрохирургическая операция должна быть закончена герметичным ушиванием ТМО. В ситуациях, когда имеются значительные дефекты ТМО, приходится использовать синтетические пластические материалы для пластики ТМО. Во избежание травматизации при зашивании ТМО на кору головного мозга следует уложить резиновую полоску или ватник, который по мере зашивания извлекается. Во избежание скопления крови в эпидуральном пространстве ТМО должна быть подшита по центру к костному лоскуту.
Достаточно гастой ошибкой является зашивание ТМО редкими, наложенными герез 0,5 – 1,0 см, швами. При этом хирург рассчитывает, что редкие швы при пролабировании мозга в дефект обеспечат декомпрессивный эффект. Такое мнение глубоко ошибочно. Отекающий и выбухающий мозг внедряется в межшовные промежутки и в них ущемляется. Это приводит к некрозу ткани мозга, следовательно, к возможности роста функциональных дефектов. Кроме этого, резко возрастает опасность нагноения раны, так как некротизированные участки ткани мозга являются хорошей питательной средой для патогенной микрофлоры.
ТМО следует ушивать наглухо, частыми швами (промежутки менее 0,5 см). Если же такой возможности не имеется в силу выраженного пролапса или ожидания такового в послеоперационном периоде, с целью обеспечения декомпрессионного эффекта производят свободную пластику трансплантатом. Как уже указывалось выше, предпочтительнее использовать синтетические пластические материалы или лиофилизированную ТМО. В большинстве неспециализированных стационаров такой возможности нет. Применение для пластики ТМО фасции из бедра больного, мышцы или фибринной пленки в настоящее время признано нецелесообразнъш. Опыт показывает, что эти материалы не только не предохраняют от формирования рубцов между мозгом и мягкими тканями, но даже увеличивают вероятность такого сращения. В связи с этим нами рекомендуется закрытие дефектов ТМО участком надкостницы.
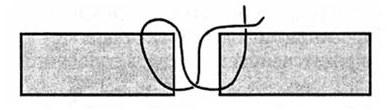
Рис. 46. Схема фиксации костного лоскута 8-образной лигатурой
Переходя к завершающему этапу операции, хирург решает важный вопрос. Укладывать ли костный лоскут на прежнее место или обеспечить наружную декомпрессию путем его удаления? В мирное время при закрытой ЧМТ после удаления патологического "внутричерепного процесса может быть выполнена первичная пластика свода черепа собственным костным лоскутом. Фиксация костного лоскута к материковой кости производится 8-образными шелковыми или проволочными швами (рис. 46). При наличии значительного пролабирования мозговой ткани в дефект, загрязнении раны первичная пластика костного дефекта не показана.
Что делать с костным лоскутом? Его можно сохранить для последующей аутокраниопластики простым и доступным способом консервации. Костный лоскут помещают в стеклянный сосуд с 0,5 % раствором формалина на физиологическом растворе натрия хлорида. Хранение проводится в обычном холодильнике при температуре + 4 °C. Консервирующий раствор меняют один раз в неделю. Через три недели трансплантат переносят в 0,25 % раствор формалина. Смену консервирующего раствора производят один раз в месяц. Минимальный срок консервации – три недели, максимальный – до 3 лет. При таком способе консервации кость сохраняет свою структуру и в последующем способна вступать в обменные процессы с тканями реципиента.
Возможно сохранение костного лоскута и другим способом. Его помещают временно в подкожную жировую клетчатку передней брюшной стенки или бедра. Хранение костного лоскута в подкожной жировой клетчатке ограничено 2 – 3 месяцами, так как в более поздние сроки наступают процессы резорбции с вымыванием ионов кальция. До настоящего времени нет однозначного мнения о необходимости дренирования послеоперационных ран. Многие нейрохирурги считают, что при достаточно тщательном гемостазе надобность в дренажах отпадает. Однако большинство хирургов все же склонны к постановке дренажей.
Какие дренажи лугше ставить? Предпочтение следует отдавать активным подкожным дренажам, которые обеспечивают возможность эвакуации скоплений крови и ликвора и снижают вероятность развития инфекционных раневых осложнений.
В случаях, когда в распоряжении нейрохирурга не имеется специального дренажа, можно использовать приспособление, которое быстро и легко изготовить в операционной. В стерильной трубке от капельницы, на конце, который будет располагаться под кожей, ножницами проделать 5 – 6 отверстий. Рядом с нижним углом раны в коже скальпелем образовать контрапертуру, через которую вытянуть зажимом предварительно скошенный другой конец трубки. После этого расправить дренаж под кожным лоскутом и зашить апоневроз и кожу. Дренажную трубку необходимо во избежание ее миграции фиксировать шелковой лигатурой к коже. На контрапертуру наложить провизорный шов, который будет затянут после удаления дренажа. К дренажу подсоединяется предварительно сжатая груша или специальный гофрированный пластиковый цилиндр. Если же таковых в распоряжении не имеется, то к трубке можно подсоединить шприц на 20 – 50 мл с вытянутым поршнем, создающим разрежение. Препятствовать втяжению поршня в павильон может вставленный колпачок от длинной иголки.
Рекомендуются к использованию и так называемые приливноотливные системы дренирования ран (рис. 47).
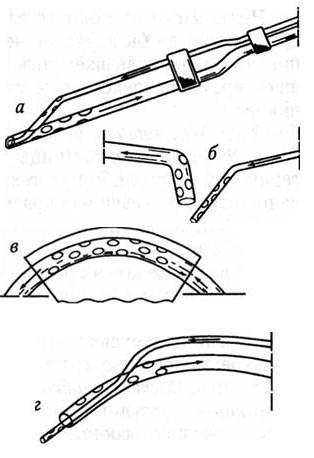
Рис. 47. Схемы основных приливно-отливных систем а, б, в, г – варианты систем
Особенно показано их применение при инфицировании ран, наличии детрита. Двойные полихлорвиниловые трубки без создания вакуума выполняют не только функцию дренирования, но и обеспечивают возможность контроля ВЧД, введения лекарственных препаратов и локальной гипотермии. Охлажденный раствор (фурацилин, физиологический раствор + антибиотики и ферменты) вводится капельно по одной трубке. Через другую трубку выводятся сгустки крови, детрит и другие продукты промываемой раны.
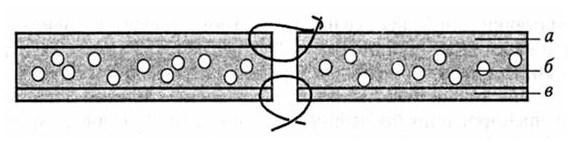
Рис. 48. Схема наложения инвертированного шва на апоневроз и шва на кожу:
а – кожа; б – подкожная жировая клетчатка; в – апоневроз
Количество влитой и вылитой жидкости должно быть одинаковым. Промывные жидкости должны отводиться в закрытые сосуды. Дренажные трубки необходимо выводить не через рану, а через контрапертуры. Скорость перфузии – 6 – 8 мл/мин. Срок применения подобных систем – 2 – 3 сут.
Независимо от количества и характера отделяемого активный дренаж должен быть удален через 24 ч. Более длительное нахождение его в ране повышает риск инфекционных осложнений. В настоящее время не рекомендуется использование резиновых выпускников.
Послойное зашивание мягких тканей предполагает:
1. Ушивание надкостницы по периферии костного лоскута к материковой части либо при технике свободного лоскута – сопоставление ранее рассеченных краев.
2. Ушивание мышц производится узловыми швами с захватом фасции.
3. Ушивание кожи производится обычным шелком или синтетическим шовным материалом размера 3 – 0. Швы накладываются обычные узловые. Ни в коем случае нельзя перетягивать края раны во избежание нарушения кровообращения в тканях, что будет препятствовать прочному сращению. Достаточно простого сопоставления краев раны. Частой ошибкой, особенно при дефектах мягких тканей, возникших в результате чрезмерного или вынужденного иссечения нежизнеспособных тканей вокруг случайных ран, является завязывание швов с большим натяжением. При этом хирург старается наложить швы как можно чаще, что, по его мнению, поможет натянуть края раны. Частые швы (чаще чем через 1 см) и большое натяжение приводят к развитию ишемического краевого некроза раны. Выходом из таких ситуаций может быть формирование послабляющих разрезов, способы пластики встречными лоскутами.
На современном этапе обязательным считается поэтажное сшивание кожно-апоневротического лоскута (рис. 48).
Чем обусловлена необходимость наложения поэтажных швов? Кожно-апоневротический рубец становится достаточно прочным спустя 1,5 мес. Кожные швы снимают на 7 – 8-е сутки. В дальнейшем рану удерживают от расхождения инвертированные апоневротические швы. Для кожно-апоневротических швов целесообразно использовать рассасывающиеся шовные материалы (викрил).
Если при зашивании кожи возникает достаточно интенсивное кровотечение, не следует коагулировать края раны. Наилучший гемостаз – это быстрое зашивание кожной раны.
Наложение традиционной сухой асептической повязки на голову в конце операции приводит к прилипанию ее к ране и сопряжено с последующими неприятными ощущениями для пациента во время перевязки. Целесообразно накладывать повязку с любой стерильной мазью, что способствует быстрой эпителизации и безболезненной ее смене.
Через 24 ч на ране с идеально сопоставленными краями и наложенной мазевой повязкой образуется монослой эпителиальных клеток, устойчивый к инфекции. Через 24 ч выполняется первая перевязка с удалением дренажа и наложением вновь мазевой повязки на одни сутки. Через 48 ч делается вторая перевязка, во время которой рана обрабатывается антисептиком и оставляется открытой, без повязки. Через 2 сут. повязка не нужна. Рана к этому времени хорошо защищена новообразованным эпителием. Больные могут мыть голову обычным шампунем и принимать душ без опасения инфицирования раны. К тому же значительно экономится перевязочный материал. Туалет раны антисептиками после 48 ч практического значения не имеет [Кушель Ю. В., Семин В. Е„ 1998].
Виды и техника остановки кровотечения
Нейрохирургия – это искусство гемостаза. От правильности проводимых мероприятий по остановке и профилактике интраоперационного кровотечения зачастую зависит исход вмешательства. В распоряжении нейрохирургов имеется достаточно средств и методов остановки кровотечения. Основных методов три.
1. Термокоагулящия (диатермия монополярная и биполярная).
2. Механигеский гемостаз (воск, клипсы, лигатуры, тампонада ватниками, кусочками мышц).
3. Химигеский гемостаз (гемостатическая губка, окисленная целлюлоза).
Термокоагуляция. Физическая основа термокоагуляции, в частности монополярной коагуляции, заключается в свойстве тканей нагреваться в силу сопротивления при прохождении через них электрического тока. Пассивный электрод накладывается на бедро или голень. Очень важно соблюсти во избежание ожога условие хорошего контакта пассивного электрода с кожей. Для этого место прикладывания электрода должно быть чистым и обезжиренным. Между электродом и кожей вставляется матерчатая прокладка, пропитанная физиологическим раствором, в крайнем случае – обычной водой. При возможности целесообразно использовать специальные электролитические гели.
Рабочий электрод, имеющий малую площадь контакта, способствует большому нагреву ткани и ее коагуляции. Увеличение силы тока может давать эффект рассечения ткани. Вариации двух режимов работы монополярного коагулятора используются нейрохирургами в повседневной практике. В режиме коагуляции важно помнить ряд условий, которые обеспечивают успешную работу:
1) чем меньше площадь контакта активного электрода с тканью, тем выше его эффективность;
2) сильное давление на ткань электродом приводит к его пригоранию и ухудшению эффекта;
3) прикосновение к коагулируемому объекту должно иметь поглаживающий характер.
Режим резания применяется только в бессосудистых областях (срединный доступ в заднюю черепную ямку по белой линии).
При биполярной коагуляции ток проходит между двумя рабочими электродами ограниченной площади (кончики пинцета) и ткань, находящаяся между ними, в результате сильного нагрева коагулируется.
Основные принципы успешного использования биполярной коагуляции следующие:
1. Правильный подбор силы тока для того, чтобы ткань не обугливалась, а коагулировалась.
2. Необходима хорошая визуализация кровоточащего сосуда. Коагуляция в «лужице» крови или в блоке большого массива ткани приведет лишь к образованию толстого слоя коагулата, из которого может продолжаться кровотечение.
3. Коагуляция сосуда должна проводиться не точечно, а на достаточном протяжении.
4. При необходимости коагуляции крупного сосуда следует наложить кровоостанавливающий зажим или пережать сосуд другим пинцетом и коагуляцию произвести вблизи зоны пережатия. Попытки произвести коагуляцию без пережатия приводят к прилипанию сосуда к пинцету и разрыву его стенки.
5. Во избежание быстрого нагорания на пинцете область коагуляции следует слегка орошать физиологическим раствором.
6. Безопасная биполярная коагуляция возможна при использовании изолированных пинцетов. Если же такового не имеется, следует исключить возможность прикосновения пинцета к «берегу» раны, что приводит к шунтированию тока и неэффективности коагуляции.
7. Если все же на пинцете образовался нагар, то его ни в коем случае нельзя счищать острым предметом, что приводит к повреждению защитного покрытия и в последующем к еще большему пригоранию. Пинцет можно отмочить в сосуде с перекисью водорода и затем очистить влажной салфеткой.
Механический гемостаз. Воск применяется для остановки кровотечения из диплоических сосудов кости. Предварительно подогревать воск на водяной бане не имеет смысла, так как правильно приготовленный воск при комнатной температуре достаточно пластичен. Сформированная «колбаска» из воска размерами чуть больше предполагаемого участка для гемостаза прикладывается к кости и прижимается по всей поверхности пальцем или лопаточкой. После придавливания производятся размазывающие движения по срезу кости. Избыток воска можно удалить ложечкой или диссектором. Часто можно видеть, как хирург длительное время производит размазывание воска салфеткой. Воск лучше прилипает к салфетке, чем к кости, и процедура гемостаза становится более длительной и менее эффективной.
Применение воска должно быть обосновано. Не следует использовать его с «профилактической» целью или при отсутствии кровотечения из кости, так как он препятствует ее регенерации в зоне распила. Отмечены случаи отторжения воска в отдаленном послеоперационном периоде с формированием серозно-гнойных свищей. В тех случаях, когда по тем или иным причинам у хирурга нет в распоряжении воска, кровотечение из кости может быть остановлено следующими способами:
– после визуализации кровоточащего диплоического канала кусачками осторожно производится сплющивание кости в этом месте;
– возможна остановка кровотечения втиранием кусочка предварительно раздавленной мышцы.
Клипсы. Во многих нейрохирургических стационарах до сих пор используются специальные клипсы для остановки кровотечения из сосудов головного мозга. Успех такого гемостаза может быть обеспечен при соблюдении ряда условий:
1. Клипсодержатель (рабочий инструмент) должен быть отрегулирован в соответствии с размерами клипс, для того чтобы они в самый неподходящий момент не выпадали, не соскальзывали и не разворачивались в ране.
2. Накладывать клипс на кровоточащий сосуд следует только после четкой его визуализации. Накладывание их вслепую, наугад приводит только к скоплению инородных тел в мозговой ране.
3. Пережатие сосуда должно быть полным и надежным.
В последнее время в связи с широким использованием биполярной коагуляции применение клипс становится более редким. Обусловлено это не только нежеланием нейрохирургов оставлять инородные тела в ране, но и сложностями оценки состояния мозга в послеоперационном периоде при контрольной компьютерной томографии. Металлическая плотность клипс на КТ-граммах вызывает множество помех и артефактов, что не позволяет дать полноценную и достоверную трактовку состояния зоны вмешательства.
Лигатуры. Применение лигатур в нейрохирургической практике для целей гемостаза не нашло широкого распространения. Однако в условиях районных больниц, где не имеется диатермокоагуляторов, нейрохирургу для предотвращения кровотечения из сосудов ТМО приходится перед ее рассечением прошивать и перевязывать сосуды оболочечной артерии. Возможно также лигирование кровоточащей поверхностной височной артерии при ее повреждении во время доступа.
Химический гемостаз. Желатиновая губка способна впитать в себя кровь в десятки раз больше собственной массы и придавливать кровоточащую поверхность. На этом свойстве основан принцип гемостаза желатиновой губкой или ее аналогами. При использовании следует избегать сильного давления на губку, применения слишком толстого куска губки и нахождения в ране с признаками инфицирования. Губка полностью рассасывается через 40 – 45 сут.
Окисленная целлюлоза. Гемостатический эффект основан на ее способности окисления в тканях. При этом в формирующейся среде с низким рН образуется кислый гематин. Гемостаз наступает через 3 – 4 мин. Срок рассасывания составляет около 5 нед. На практике отмечено отсутствие формирования оболочечно-мозгового рубца, если между линией разреза ТМО и корой головного мозга проложить кусочки окисленной целлюлозы.
| Назад | Оглавление | Далее |