Дети-инвалиды
Нейрофизиологический аспект
Для выяснения нейрофизиологических механизмов локомоторных нарушений у больных ДЦП оказалось полезным сопоставление данных изучения функционального состояния спинного мозга и распределения электрической активности мышц в течение цикла ходьбы.
Состояние нейрональных систем рефлекторных дуг (мотонейронов и интернейронов спинного мозга) определялось путем исследования взаимодействия сухожильных рефлексов нижней конечности (А.В.Саранцев, А.С.Витензон, 1970). Была исследована группа здоровых испытуемых и больных ДЦП. В качестве примера рассмотрена лишь одна комбинация взаимодействия рефлексов, когда в качестве
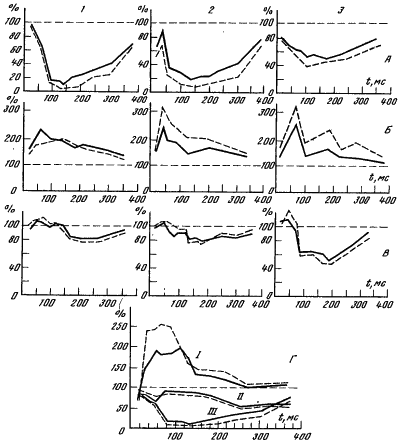
Рис. 34. Изменение величины электромиографического компонента Ахиллова рефлекса под влиянием коленного (1), с двуглавой или полусухожилъной мышц (2) и аддукторного (3) рефлексов:
А — у здоровых людей (резкое торможение рефлекса), Б — у больных ДЦП с выраженной спастичностыо мышц (резкое усиление рефлекса), В — у больных с нерезкой спастичностыо мышц (слабое торможение), Г — изменение величины Ахиллова рефлекса под влиянием коленного у больного ДЦП до (I) и после аддукторотомии (II); для сравнения дана норма (III). Сплошная линия — электромиографический компонент рефлекса ОТ камбаловидной мышцы, пунктир — от икроножной мышцы: На оси ординат — значение Ахиллова рефлекса (100%, — его значение без обусловливающего рефлекса), на оси абсцисс — интервал между обусловливающим и тестируемым рефлексами.
тестируемого рефлекса взят Ахиллов рефлекс, а в качестве обусловливающего — коленный рефлекс, а также рефлексы с сухожилий двуглавой мышцы бедра и приводящих мышц (рис. 34). В результате экспериментов было установлено, что наиболее частым эффектом взаимодействия сухожильных рефлексов у здоровых людей является торможение. Обычно тестируемый рефлекс тормозится через 30—80 мс после обусловливающего, длительность торможения приблизительно равна 250 мс и более, интенсивность торможения в среднем составляет 40—60% исходной величины, а иногда бывает и более глубокой.
У больных ДЦП торможение выражено значительно слабее, в ряде случаев оно не проявляется вообще, а иногда наблюдаются эффекты возбуждения, особенно при интервалах 100—200 мс между обусловливающим и тестируемым рефлексами. В целом отмечено, что чем сильнее спастичность мышц, тем меньше взаимоторможение ипсилатеральных сухожильных рефлексов.
Полученные данные могут быть объяснены исходя из современных представлений о природе внутрицентрального торможения. Согласно последним, существуют два основных вида торможения в ЦНС: одно из них развивается в самом нейроне вследствие гиперполяризации клеточной мембраны и поэтому называется постсинаптическим, другое возникает на уровне окончаний аксонов первичных афферентов и определяется как пресинаптическое торможение (Экклс, 1966).
При взаимодействии сухожильных рефлексов могут наблюдаться как постсинаптическое, так и пресинаптическое торможение. Однако первое характеризуется специфичностью и продолжается сравнительно недолго, в пределах 100—200 мс, тогда как пресинаптическое торможение длится значительно дольше и не отличается специфичностью.
Поскольку все виды внутрицентрального торможения опосредуются спинальными интернейронами, деятельность которых контролируется различными отделами головного мозга, то следует думать, что у больных ДЦП вследствие ослабления супраспинальных влияний в связи с описанной выше патологией развития основных структур, контролирующих моторику, наступает дефицит постсинаптического и в особенности пресинаптического торможения. Этот дефицит внутрицентрального торможения приводит либо к непосредственному повышению возбудимости альфа-мотонейронов (в случае постсинаптического торможения), либо к избыточному притоку афферентных импульсов к ним, так как пресинаптическое торможение контролирует величину афферентного притока к мотонейронам.
Указанная точка зрения позволяет понять различные клинические феномены: понижение спастичности мышц в покое, после блокады или пересечения афферентных нервов и, наоборот, значительное повышение рефлекторного тонуса при экстероцептивных раздражениях, движениях, когда вследствие недостаточного ограничения приходящей импульсации от разных рецепторов может возникать “избыточная афферентация”, возбуждающая альфа-мотонейроны спинного мозга. Подтверждением этой гипотезы являются эксперименты, в которых выявлено усиление взаимного торможения рефлексов после некоторых операций (адцукторотомии) у ряда больных.
Казалось бы, что в условиях дефицита внутрицентрального торможения электрическая активность мышц при ходьбе не дблжна иметь упорядоченный характер. Однако при ходьбе больных ДЦП с умеренным поражением двигательных функций обычно наблюдается правильное чередование фаз активности и покоя в течение локомоторного цикла.
Для того чтобы разрешить это противоречие, обратимся к современным представлениям о структуре и механизмах нервной регуляции работы мышцы при локомоции у животных (МЛ.Шик, 1976) и человека (А.С.Витензон, 1974).
Исследование управления локомоцией животных показывает, что программа шагательных движений формируется уже на уровне спинного мозга. На долю различных отделов головного мозга приходятся такие функции, как запуск этой программы, контроль ее интенсивности, организация межконечностного взаимодействия. Необходимым компонентом этой управляющей системы является афферентный приток от конечности, который служит как для активации интра- спинального механизма шагательных движений, так и для осуществления разнообразных коррекций на уровне спинного и головного мозга.
При ходьбе человека также действует центральная иннервацион- ная программа, о которой можно судить по распределению электрической активности мышц в течение локомоторного цикла. В основе этой программы, несмотря на многоуровневый характер управления локомоций, по-видимому, лежит также деятельность относительно автономного интраспинального механизма шагательных движений. Вследствие этого супраспинальные и афферентные факторы оказывают влияние на ходьбу лишь с учетом существующей программы мышечных возбуждений.
Соотношение супраспинальных и афферентных влияний зависит от условий протекания локомоции. При повышении темпа ходьбы изменение амплитуды электрической активности мышц, т.е. числа активированных альфа-мотонейронов спинного мозга, является прерогативой супраспинального управления. При постоянном темпе ходьбы, но изменяющейся нагрузке на мышцы афферентные факторы также влияют на амплитуду электрической активности мышц.
Как видно из представленных материалов, у больных ДЦП с умеренным поражением нижних конечностей сохраняется йнтраспиналь- ная программа ходьбы, о чем свидетельствует фазовый характер активности мышц в локомоторном цикле.
По-видимому, нарушения внутрицентрального торможения ограничиваются нейрональными системами рефлекторных дуг спинного мозга, не затрагивая непосредственно ритмическую деятельность спинального механизма шагательных движений.
В то же время следует допустить, что повышение активности мышц и известное нарушение реципрокных отношений, проявляющееся в одновременной активности мышц-антагонистов в течение шага, является результатом не только подстройки нервных процессов к новой биомеханике ходьбы, но и неизбежным следствием изменения функционального состояния сегментарного аппарата спинного мозга.
Существенно не изменяется и супраспинальное управление работой спинального механизма шагательных движений. При повышении темпа ходьбы изменения биомеханических и электрофизиологических параметров аналогичны тем, которые имеют место при нормальной ходьбе. Определенные отличия, которые все же наблюдаются в характере зависимостей различных электрофизиологических параметров от темпа при ходьбе больных ДЦП, вероятно, следует связывать с особенностями текущей афферентации от конечности и дальнейшей ее переработкой нейрональными системами рефлекторных дуг.
Рассмотренные данные исследований позволяют дать биомеханическое и нейрофизиологическое обоснование следующих принципов реабилитации больных ДЦП: 1) ограничения афферентации от рецепторов мышц и суставов конечности как способа уменьшения высокой рефлекторной возбудимости спинальных мотонейронов (спастичности мышц); 2) коррекции патологической сгибательной позиции нижних конечностей, как способа нормализации биомеханических характеристик стояния и ходьбы, снижения их энергической “стоимости, 3) улучшения двигательной активности и выработки правильного стереотипа ходьбы на уже скоррегированном периферическом фоне.
Первый и второй принципы могут быть осуществлены посредством системы консервативных и хирургических мероприятий. Реализация третьего принципа наряду с использованием традиционных методов и средств лечебной физкультуры предполагает применение новых способов восстановления двигательных функций, к которым относится искусственное управление движениями при ходьбе посредством электрической стимуляции мышц.
| Назад | Оглавление | Далее |