Медицинская реабилитация
Исследования по проблеме повреждения спинного мозга: достижения и перспективы
Wise Young, PhD MD
W. M. Keck Center for Collaborative Neuroscience
Rutgers University, Piscataway, New Jersey
декабрь 2003 г.
Состояние на 1995 г.
- Лечение острого и подострого SCI
- Метилпреднизолон (Methylprednisolone) оказывает нейропротекторное действие (NASCIS, 1990)
- GM1 улучшает восстановление движений у людей (Geisler, 1991)
- Лечение спастичности и боли
- Интратекальное введение баклофена при выраженной спастичности
- Антидепрессант амитриптилин (Elavil) при нейропатической боли
- Перспективные виды лечения
- IN-1 антитела стимулируют регенерацию у крыс (Schwab, 1991-)
- Внутривенное введение 4-аминопиридина (4-aminopyridine) улучшает функцию у некоторых больных с хроническим SCI (Hansebout, 1992-)
- Трансплантаты фетальной ткани приживаются у животных (Reier, 1992-)
- Функциональная регенерация спинного мозга у новорожденных (Kawaguchi, 1994-)
- Трансплантаты нейротропин-секретирующих фибробластов (Tuszynski, 1994-)
В 1995, когда Кристофер Рив (американский киноактер) получил спинальную травму, он спросил меня, появится ли когда-нибудь терапия, которая могла бы восстановить функцию при повреждении спинного мозга (Spinal Cord Injury - SCI). Я сказал, что уверен в этом. Это убеждение было основано на следующих данных научных исследований. Препарат метилпреднизолон (methylprednisolone) улучшает неврологическое восстановление, если вводится внутривенно не позже 8 часов после травмы спинного мозга, - это ранняя "нейропротекторная" терапия. Другое лекарство, названное GM1 или моносиаловый ганглиозид (monosialic ganglioside), стимулирует восстановление движений у больных, если лечение начинается не позже 48 часов после травмы и продолжается 6-8 недель. Schwab и соавт. (1991) показали, что IN-1-антитела связываются с миелин-ассоциированным белком, затрудняющим рост аксонов, блокируют его и, тем самым, стимулируют регенерацию в поврежденном спинном мозге крыс. Reier и соавт. (1993) обнаружили, что трансплантаты фетальной ткани приживаются в поврежденном спинном мозге. Kawaguchi и соавт. (1994) сообщили, что точное сопоставление концов пересеченного спинного мозга крыс делает возможным регенерацию и функциональное восстановление. Tuszynski и соавт. (1994) генетически модифицировали фибробласты, чтобы усилить выделение нейротрофинов, пересаживали эти клетки в поврежденный спинной мозг и доказали, что фибробласты стимулируют регенерацию. Стимулятор GABA-B-рецепторов баклофен, вводимый интратекально (под оболочки спинного мозга), уменьшал выраженную спастичность, а антидепрессант амитриптилин начали использовать для лечения невропатической боли. Препарат 4-аминопиридин, по данным Hansebout (1992), может улучшить функцию у больных с хроническим повреждением спинного мозга
Состояние на декабрь 2003 г.
Хирургическое лечение
Стабилизация позвоночника и декомпрессия спинного мозга
- Стабилизация
- Передняя и задняя пластины
- Титановый каркас и другие методы соединения позвонков
- Декомпрессия может восстанавить функцию спинного мозга и в поздние сроки после травмы (Bohlman)
- Устранение фиксации спинного мозга улучшает функцию
- Адконовый гель и другие методы, препятствующие эпидуральному рубцеванию
Сирингомиелические кисты
- Удаление субдуральных спаек
- Восстановление ликвородинамики
- Трансплантация твердой мозговой оболочки для предотвращения повторного образования спаек
Урологические процедуры
- Надлобковая катетеризация и подвздошные туннели (Mitrafanoff)
- Искусственные сфинктеры для мочевого пузыря и кишечника
Создание перемычек из периферических нервов
- Имплантация оторванных корешков или нервов в спинной мозг для
- мышечной реиннервации
- уменьшения нейропатической боли
- реиннервации мочевого пузыря.
- Соединение добавочных, межреберных и локтевых нервов с диафрагмальным, седалищным, пудендальным и другими периферическими нервами
- Анастомозы "конец-в-бок"
Достижения хирургии произвели переворот в лечении травмы спинного мозга. В 1980-х и начале 1990-х, больные с переломом позвоночника помещались на вытяжение и часто подвергались хирургической декомпрессии только через несколько дней или даже недель.
Использование металлических пластин позволяет добиться немедленной стабилизации позвоночника. Сейчас декомпрессия спинного мозга и мобилизация больных производится вскоре после травмы, что делает возможным более раннюю реабилитацию и сокращение срока пребывания в стационаре. Bohlman и соавт. показали, что операции декомпрессии или устранения фиксации спинного мозга могут привести к восстановлению функций даже через годы после травмы. Лечение сирингомиелических кист также совершенно изменилась. До недавних пор, большинство сирингомиелических кист лечили шунтированием, что приводило к повторному появлению кисты в 80% случаев. Green и соавт. показали, что удаление спаек, трансплантация твердой мозговой оболочки и восстановление тока цереброспинальной жидкости вокруг места повреждения приводит к долгосрочному исчезновению кисты в 80% случаев. Урологические процедуры также значительно улучшили качество жизни некоторых больных с повреждением спинного мозга. Например, установка надлобковых катетеров, подвздошные туннели и операция Митрофанова устраняют инфекции мочевого тракта и увеличивают независимость больных. По мере накопления опыта и появления более совершенных приспособлений, искусственные сфинктеры для мочевого пузыря и кишечника начинают давать хорошие результаты.
Наконец, многие хирурги применяют прогрессивные методы создания перемычек из периферических нервов для восстановления функций. Например, оторванные корешки можно заново соединить со спинным мозгом. Периферические нервы используются для соединения поврежденного спинного мозга и создания новых путей, чтобы восстановить функции мышц и мочевого пузыря.
Медикаментозная терапия
- Лечение в подостром периоде
- Моносиаловый ганглиозид (GM1) ускоряет двигательное восстановление (Geisler, 1999)
- Устранение нейропатической боли
- Введение лекарств под оболочки спинного мозга
- Противоэпилептические препараты:
- Высокие дозы Neurontin (gabapentin), то есть. 2000-4000 мг/день могут привести к стабильному облегчению нейропатической боли
- Карбемапазин
- Блокаторы глютаматных рецепторов:
- Dextromethorphan
- Кетамин внутрь
- Каннабиоиды
- Опиоиды
- Антиспастическая терапия
- При спастичности мочевого пузыря
- Внутрипузырное введение дитропана
- Сapsaicin внутрипузырно
- Тизанидин (блокатор альфа-адренорецепторов, подобный клонидину)
- Пероральный 4-аминопиридин
- Уменьшает боль и спастичность (Hayes и соавт., 1998)
- Может улучшить функции мочевого пузыря, кишечника и сексуальную функцию
- Может улучшить двигательную и сенсорную функцию у трети пациентов с хроническим SCI
- Уменьшает спастичность, не вызывая мышечную слабость.
- При спастичности мочевого пузыря
Медикаментозная терапия при травме спинного мозга значительно усовершенствовалась за последние семь лет. В 1999 г. Geisler и соавт. сообщили, что моносиаловый ганглиозид (GM1), вводившийся не позднее 48 часов после травмы, и терапия метилпреднизолоном ускоряют неврологическое восстановление, но не приводят к значимому улучшению в сроки 6-12 месяцев после повреждения. Появилось несколько новых методов лечения нейропатической боли. В некоторых клиниках используется введение лекарств, в том числе морфина, под оболочки спинного мозга. Некоторые антиэпилептические лекарства оказывают выраженный эффект в купировании нейропатической боли, особенно большие дозы неуронтина (габапентина) и карбемапазин. Также помогают блокаторы глютаматных рецепторов и каннабиноиды. Новый метод лечения спастичного мочевого пузыря - внутрипузырное введение препаратов. Например, дитропан при введении в мочевой пузырь уменьшает его спастичность при меньших побочных эффектах. Капсаицин (сapsaicin) - экстракт перца, вводимый внутрипузырно, поглощается нервными волокнами и приводит к истощению субстанции P в спинном мозге, стойко (на 2-3 месяца) уменьшая спастичность пузыря. Тизанидин - блокатор альфа-адренорецепторов, подобный клонидину, недавно был апробирован для купирования спастичности. Наконец, 4-аминопиридин (4-AP), может уменьшить боль и спастичность, а также улучшить чувствительность и двигательную функцию у больных с демиелизированными аксонами при хроническом повреждении спинного мозга. Третья фаза клинических испытаний этого препарата близится к завершению. Если результат будет положительным, 4-AP станет первым лекарством, уменьшающим спастичность, не ухудшая двигательную функцию.
Реабилитация
- Функциональная электрическая стимуляция (FES)
- Диафрагмальные пейсмейкеры
- Стимуляторы мочевого пузыря
- крестцовая стимуляция по Brindley
- стимулятор Medtronics при недержании мочи
- тренирующий стимулятор
- Стимуляторы руки
- Ness
- Freehand
- Ручные и ножные велосипеды
- Стимуляторы движения ног (Parastep)
- Устранение "learned non-use"
- Тренировка форсированным использованием
- Даже за короткий период бездеятельности нервных цепей возникает феномен "learned non-use" ("разучился использовать")
- Интенсивное использование восстанавливает двигательную функцию при хронической гемиплегии (Taub, 2000)
- Терапия с использованием обратной биологической связи (Biofeedback-терапия)
- Тренировка ходьбы на тредмилле (бегущей дорожке) с поддержкой веса тела (Wernig и соавт. (Германия), Dobkin и соавт. (Калифорнийский Университет в Лос-Анжелесе)
- Тренажеры: Lokomat, Ambulator, Glider (ручной)
- Тренировка форсированным использованием
Появилось много новых методов реабилитации. Функциональная электрическая стимуляция (FES) обычно применяется, чтобы активизировать парализованные мышцы.
Имплантация крестцовых электростимуляторов используется для активизации мочеиспускания и предотвращения недержания мочи. Применяются наружный (Ness) и внутренний (Freehand) стимуляторы руки. Многие аппараты для электростимуляции соединяют с устройствами для тренировки такими, как велотренажер, чтобы предотвратить мышечную атрофию. Но, возможно, наиболее важным достижением в реабилитации было осознание роли феномена "learned non-use" ("разучился использовать"). Этот термин имеет отношение к нервным цепям (даже анатомически сохранным), выключающимся после длительных периодов бездеятельности. Подобно мышцам, которые атрофируются, если не используются, нервные цепи также могут подвергнуться атрофии. Поскольку люди после травмы спинного мозга восстанавливаются медленно и на долгий срок остаются неактивными, возникающий феномен "learned non-use" может препятствовать функциональному восстановлению. Несколько последних исследований показали, что "learned non-use" можно обратить интенсивными упражнениями даже после десятилетий паралича. Taub и соавт. обнаружили, что больные с гемиплегией после инсульта могут восстановить функцию, если будут принуждены пользоваться парализованными руками. Терапия с использованием обратной биологической связи также может значительно улучшить двигательную функцию. Но, возможно, наиболее впечатляющие достижения наблюдаются в восстановлении ходьбы. Wernig и другие исследователи сообщили, что интенсивная тренировка ходьбы на тредмилле (бегущей дорожке) может восстановить способность к ходьбе у большинства людей с неполным повреждением спинного мозга, даже если они никогда не ходили после травмы. Для облегчения такой тренировки разработаны различные устройства и тренажеры.
Регенеративная Терапия
Блокада ингибитора роста аксонов
- Nogo антитела IN-1 (Schwab и соавт., 1990-2003)
- Rho-ингибитор (McKerracher, 2001)
- Хондроитиназа (Bradbury, 2002)
- Блокаторы Nogo-рецепторов (Strittmatter, 2001-2003)
Пуриновые нуклеотиды
- Модифицированный гуанозин AIT-082 (Neotherapeutics)
- Инозин (Benowitz и соавт., 1999)
- Аденозин (Chao и соавт., 2000)
Терапевтические вакцины
- Гомогенезированная вакцина из спинного мозга (David и соавт., 1999)
- Nogo/MAG вакцины (Schwartz и соавт., 2003)
Переменный электрический ток (Borgens и соавт., 1997)
Клеточная трансплантация
- Оболочечная глия обонятельной луковицы
- обонятельная луковица взрослых (Ramon-Cuetos, 2000);
- слизистая носа (Lu и соавт., 2002);
- фетальная обонятельная луковица (Huang и соавт., 2003).
- Стволовые клетки костного мозга (Black и соавт.; Barros, 2003)
- Нервные стволовые клетки (см. ниже) (Okano и соавт.), корешковая глия (Grumet и соавт., 2003)
Факторы роста
- FGF+GDNF (Cheng и соавт.,1996, 2003)
- Комбинация нейротрофинов (Xu, 2001)
- cAMP и Rollipram (Filbin, 2001)
- L1 (Roonprapunt и соавт., 2003)
- Эритропоэтин (Gorio и соавт., 2003)
Многие методы способны улучшить регенерацию при травме спинного мозга у животных. В их числе антитела против Nogo (Schwab и соавт., 2000-2003), блокаторы Nogo-рецепторов (Strittmatter и соавт., 2003), хондроитиназа АВС, которая расщепляет хондроитин-6-сульфат протеогликан (Bradley и соавт., 2002), C3-rho ингибитор (McKerracher и соавт., 2002), который связывает внутриклеточные блокаторы роста. Пуриновые нуклеотиды: инозин, AIT-082 (модифицированный аналог гуанозина) и аденозин стимулируют рост аксонов и пролиферацию стволовых клеток. David и соавт. обнаружили, что вакцинация мышей гомогенатами спинного мозга, а также такими компонентами миелина, как Nogo или миелинассоциированными гликопротеинами, стимулирует регенерацию и ремиелинизацию. Borgens и соавт. (1989-2002) использовали электрический ток, чтобы стимулировать регенерацию. Клеточная трансплантация улучшает функциональное восстановление у спинализированных (с рассеченным спинным мозгом) животных: активированные макрофаги (Schwartz и соавт., 1998), оболочечная обонятельная глия (см. ниже) (Ramon-Cuetos и соавт., 2002), трансплантаты слизистой носа (Lu и соавт., 2002-2003), стволовые клетки костного мозга (Black и соавт.; Barros, 2003), фетальные нервные стволовые клетки (Okano и соавт.), корешковая глия (Grumet и соавт., 2003). Cheng и соавт. (1996) использовали кислый фактор роста фибробластов (FGF) для воздействия на соединенный с помощью периферических нервов спинной мозг и глиальный нейротрофический фактор (GDNF) для лечения ушиба спинного мозга. Xu и соавт. (2002) применяли комбинацию фактора роста нервов (NGF), выделенного из мозга нейротрофического фактора (BDNF) и нейротрофина-3 (NT-3), чтобы стимулировать регенерацию в спинном мозге. Молекулы L1 клеточной адгезии могут стимулировать регенерацию и улучшать восстановление после контузий спинного мозга (Roonprapunt и соавт., 2003). Эритропоэтин оказывает нейрорегенеративное и нейропротективное действие (Gorio и соавт., 2002).
Ремиелинизирующая терапия
Лечение иммуноглобулинами
- M1-антитела стимулируют ремиелинизацию (Rodriguez, 1996)
- Копаксон (кополимер 2) улучшает восстановление у крыс (Schwartz и соавт., 2001)
Олигодендроглиальные клеточные трансплантаты
- Эндогенные клетки-предшественники олигодендроглии (Gage, 1999)
- O2A клетки-предшественники ремиелинизируют аксоны спинного мозга (Blakemore и соавт., 1996-)
- Из эмбриональных стволовых клеток возникают предшественники олигодендроглии, которые ремиелинизируют поврежденные аксоны спинного мозга (McDonald, 1999).
Олигодендроглиальные факторы роста - Neuregulin (GGF2)
Обонятельная оболочечная глия (OEG)
- Трансплантаты OEG ремиелинизируют аксоны в спинном мозге (Kocsis и соавт., 1999)
Шванновские клетки
- Миграция шванновских клеток в спинной мозг (Blight, 1988; Blakemore, 1990)
- Трансплантаты и перемычки из шванновских клеток (Bunge и соавт., 1993-2003)
- Трансплантаты периферических нервов (Kao)
Стволовые клетки (см. ниже)
- Эмбриональные стволовые клетки мыши миелинизируют спинной мозг крыс (McDonald и соавт., 2000)
- Фетальные стволовые клетки свиней (клиническое испытание Diacrin)
- Человеческие фетальные стволовые клетки (клинические исследования в Москве и Новосибирске)
Травма не только разрушает аксоны, но и повреждает олигодендроглию в спинном мозге, вызывая демиелинизацию. Многие методы лечения ремиелинизируют поврежденный или демиелизированный спинной мозг. Ученые давно знают, что шванновские клетки проникают в поврежденный спинной мозг из нервных корешков и ремиелинизируют аксоны (Blight и соавт., 1988; Blakemore, 1990). Bunge, Xu и соавт. в Проекте Майами (1993-2003) использовали перемычки из шванновских клеток, чтобы воссоединить рассеченный спинной мозг. Эндогенные стволовые клетки превращаются в предшественников олигодендроглии, которые ремиелинизируют поврежденные аксоны спинного мозга (Blakemore и соавт., 1996; Gage и соавт., 1999). McDonald и соавт. (1999) показали, что трансплантированные эмбриональные стволовые клетки (см. ниже) мыши также превращаются в предшественников олигодендроглии, которые миелинизируют обедненные миелином аксоны как у мышей, так и у крыс. Diacrin субсидировал клинические испытания трансплантации фетальных стволовых клеток свиней в спинной мозг человека. Обонятельная оболочечная глия (OEG) также ремиелинизирует аксоны, как и шванновские клетки. Kocsis и соавт. (1999) использовали OEG свиней для ремиелинизации облученного спинного мозга крыс. OEG, таким образом, может играть двоякую роль: способствовать ремиелинизации и регенерации. Внутривенное введение иммуноглобулинов используется в клинике для лечения демиелинизирующих заболеваний, таких, как рассеянный склероз и синдром Guillian-Barre. Rodriguez и соавт. (1993-2002) обнаружили моноклональные антитела, которые стимулируют ремиелинизацию. Наконец, Schwartz и соавт. сообщили, что копаксон (препарат для лечения рассеянного склероза) улучшает восстановление поврежденного спинного мозга, стимулируя иммунный ответ на основной белок миелина.
Завершенные клинические испытания
Национальное исследование острой травмы спинного мозга III (NASCIS III)
- В мультицентровом исследовании участвовало около 500 пациентов. Сначала всем внутривенно болюсом вводили метилпреднизолон (MP), затем часть больных получала 24-часовой курс 5.4 мг/кг MP, часть - 48-часовой курс 5.4 мг/кг MP, часть - 48-часовой курс tirilazad mesylate.
- 24-часовой курс MP был наилучшим, если начинался не позже 3 часов после травмы, а 48-часовой курс MP давал наибольший эффект при начале лечения позже 3 часов после травмы.
Исследование моносиалового ганглиозида (GM1, Sygen) Fidia
- В 40 исследовательских центрах США 800 пациентов лечили MP, а затем часть из них в течение 6 недель получала GM1, часть - плацебо.
- Результаты свидетельствуют, что GM1 может ускорить восстановление, но не изменяет продолжительность периода восстановления с 6-12 месяца после травмы.
Трансплантация фетального спинного мозга при сирингомиелии - Gainesville, Rush Presbyterian в Чикаго, Karolinska в Швеции, Россия (Москва, Новосибирск), Китай (Гуанчжоу, Пекин)
AIT-082 (Неотрофин) в лечении травмы спинного мозга (Ranchos Los Amigos, Gaylord, Craig, Jefferson)
Целый ряд клинических испытаний завершены с 1995. Национальное исследование острой травмы спинного мозга III (NASCIS III) обобщило результаты изучения метилпреднизолона. В испытании сначала всем больным внутривенно болюсом вводили метилпреднизолон (MP), затем часть больных получала 24-часовой курс 5.4 мг/кг MP, часть - 48-часовой курс 5.4 мг/кг MP, часть - 48-часовой курс tirilazad mesylate. 24-часовой курс оказывался наиболее эффективным, если лечение начиналось не позже 3 часов после травмы. 48-часовой курс MP давал наибольший эффект при начале лечения от 3 до 8 часов после травмы. В Fidia Sygen исследовании участвовало 800 пациентов, которые получали только 24-часовой курс метилпреднизолона или после окончания этого курса еще и моносиаловый ганглиозид GM1 (Sygen, 100 мг./день) в течение 6 недель после травмы. Результаты свидетельствуют, что GM1 может ускорить восстановление, особенно в течение первых 6 недель, но значимо не изменяет общей продолжительности восстановления в течение 6-12 месяца. В Университете Флориды (Gainesville) трансплантировали фетальный спинной мозг человека больным с прогрессирующими сирингомиелическими кистами. Клетки выживали и заполняли полость. Исследование показало, что процедура пересадки, даже с краткосрочной иммуносупрессией, была безопасной и осуществимой. Наконец, AIT-082 (Неотрофин) - модифицированный аналог гуанозина, который можно принимать внутрь, испытывался в мультицентровом двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании. Результаты еще не опубликованы.
Текущие клинические испытания
Подострый SCI
- Трансплантация активированных макрофагов в лечении подострого SCI (Proneuron) - Тель-Авив, Брюссель, Денвер, Нью-Йорк, Нью-Джерси.
- Стимуляция переменным электрическим током в лечении подострого SCI (Purdue University, Индиана)
Хронический SCI
- Фампридин SR (4-аминопиридин) в лечении хронического SCI (Acorda: Третья фаза испытания в 82 спинальных центрах США и Канады).
- Трансплантация фетальных стволовых нервных клеток свиней при хроническом SCI (см. ниже) (Diacrin: Медицинский центр Олбани и Вашингтонский Университет в Сент-Луисе).
- Трансплантация обонятельной выстилающей глии (OEG) - Брисбен (OEG взрослых), Лиссабон (слизистая носа), Пекин (фетальная OEG)
- Трансплантация стволовых клеток костного мозга - Университет Сан-Паулу (Barros)
Целый ряд клинических испытаний проводятся в настоящее время. Acorda Therapeutics завершает третью фазу мультицентрового исследования, в котором оценивается эффективность 4-аминопиридина (4-AP) у больных с хроническим повреждением спинного мозга; предшествующие 2 фазы показали, что 4-AP может улучшить неврологическую функцию и уменьшать спастичность у трети людей с хроническим повреждением спинного мозга. Proneuron начал вторую фазу мультицентрового исследования трансплантации активированных макрофагов; первая фаза испытания в Тель-Авиве и Брюсселе показала, что макрофагов можно выделить из крови, активировать и успешно пересадить в спинной мозг людей в течение двух недель после травмы. Diacrin субсидирует клиническое исследование по трансплантации фетальных стволовых нервных клеток свиней в Медицинском центре Олбани и Вашингтонском Университете в Сент-Луисе; фетальные стволовые нервные клетки свиней пересаживают людям с хроническим повреждением спинного мозга. Клиническое исследование в Purdue University (Индиана) оценивает эффективность электростимуляции переменным током, применяющейся в течение 2 недель после травмы. Обонятельную оболочечную глию (OEG) пересаживают в Пекине, Лиссабоне и Брисбене. В Пекине свыше 350 пациентов получили клетки OEG, выделенные из обонятельной луковицы зародышей. В Брисбене 3 больным пересадили клетки OEG, полученные из слизистой носа. В Лиссабоне слизистая носа пересаживается непосредственно в спинной мозг людей с хроническим повреждением спинного мозга. Наконец, Tarcisio и Erika Barros в Университете Сан-Паулу пересаживают аутотрансплантаты стволовых клеток костного мозга в спинной мозг больных с хроническим повреждением спинного мозга.
Перспективные виды терапии
Хондроитиназа
- Хондроитин-6-сульфат протеогликан (CSPG) тормозит рост аксонов в спинном мозге (Silver и соавт., 1993)
- Хондроитиназа АВС (Chase ABC) - бактериальный фермент, расщепляющий CSPG, стимулирует регенерацию (Bradbury и соавт., 2002)
Глиальный нейротрофический фактор (GDNF)
- GDNF - фактор роста, который выделяют глиальные клетки, обладает нейропротективным действием (Cheng и соавт., 2002) и стимулирует аксональный рост (Xu и соавт., 2003).
- В настоящее время проводятся клинические испытания GDNF для лечения болезни Паркинсона.
Обонятельная оболочечная глия (OEG)
- Эти специализированные клетки, происходящие из слизистой носа, мигрируют по обонятельным нервам в обонятельные луковицы. Их наличием можно объяснить способность обонятельных нервов взрослых к регенерации (Doucette и соавт., 1991)
- Клетки OEG, пересаженные в спинной мозг, стимулируют регенерацию и ремиелинизацию (Raisman и соавт., Ramon-Cueto и соавт., Kocsis и соавт., и другие с 1998-2003).
Два метода лечения привлекли особое внимание в 2003 году. Хондроитин-6-сульфат протеогликаны (CSPG) - внеклеточные основные белки, выделяющиеся астроцитами, сильно тормозят аксональный рост в месте повреждения. Хондроитиназа АВС (CABC) является бактериальным ферментом, который расщепляет CSPG. Elizabeth Bradbury и ее коллеги недавно показали, что CABC, ежедневно вводимая в спинной мозг, стимулирует регенерацию, улучшая функции у крыс после задней гемисекции. Глиальный нейротрофический фактор (GDNF) - фактор роста, который выделяют глиальные клетки. Последние исследования свидетельствуют, что GDNF оказывает нейропротективное (Cheng и соавт., 2002) и нейрорегенеративное (Xu и соавт., 2003) действие. Сейчас проводятся клинические испытания GDNF для лечения болезни Паркинсона. Клетки обонятельной оболочечной глии (Olfactory Ensheathing Glia - OEG) также оказались в центре внимания. Описанные в 1991 Doucette и соавт., эти клетки происходят из стволовых клеток слизистой носа и мигрируют по обонятельному нерву в обонятельную луковицу, где располагаются во внешних слоях обонятельной коры. Выделенные из обонятельной луковицы или слизистой носа, эти клетки могут быть пересажены в спинной мозг, где они выживают, мигрируют и ремиелинизируют аксоны. Есть сообщения, что они также способствуют регенерации аксонов.
Обонятельная оболочечная глия (Olfactory Ensheathing Glia - OEG)
Фетальные клетки OEG
- Биполярные (мигрирующие)
- Мультиполярные (направляющие?)
- "Яичница-глазунья" (оболочечные)
Маркеры
- Ламинин и L1 CAM
- Нестин
- GFAP
- P75 (рецептор NGF)
Роль в регенерации
- Рост
- Направление
- Миелинизация
Обонятельная оболочечная глия (OEG) вызывает особый интерес из-за ее способности стимулировать регенерацию и ремиелинизацию спинного мозга. Около четырех лет назад появились сообщения, что OEG улучшает неврологическое восстановление у животных. Сейчас проводятся клинические испытания трансплантации клеток OEG в Пекине, Лиссабоне, и Брисбене. Клетки OEG происходят из собственной пластинки слизистой носа, мигрируют по обонятельному нерву и размещаются в обонятельной луковице.
Полагают, что эти клетки - причина того, что обонятельный нерв является единственной структурой центральной нервной системы, непрерывно регенерирующей у взрослых. Клетки OEG в культуре образуют три формы. Биполярная форма способна к миграции. Мультиполярная форма является проводником аксонов и выделяет L1, ламинин и другие вещества клеточной адгезии, которые притягиваются к аксонам. Форма "яичница-глазунья" - покровная (оболочечная). Отмечено, что клетки OEG вырабатывают нестин (простое волокно, которое часто обнаруживают в стволовых нервных клетках) и GFAP (волокно, которое присутствует в глиальных клетках). Они также образуют P75 (рецептор со слабым сродством к нейротрофину). Пересаженные в спинной мозг, клетки OEG обычно имеют биполярную форму, но часто можно увидеть, как они миелинизируют аксоны подобно шванновским клеткам.
Клинические испытания OEG
- Лиссабон (Португалия) - Carlos Lima пересадил клетки слизистой носа в спинной мозг 10 пациентам с хроническим SCI
- Брисбен (Австралия) - Tim Geraghty и Alan McKay-Sims культивировали и пересадили 15 миллионов клеток OEG из слизистой носа четырем пациентам с хроническим SCI.
- Пекин (Китай) - Hongyun Huang культивировал OEG из фетальной обонятельной луковицы и пересадил свыше 300 больным с хроническим SCI.
- Новосибирск (Россия) - Самуил Рабинович пересадил смесь OEG и стволовых нервных клеток 15 пациентам с хроническим SCI.
Клинические испытания OEG в Пекине
| Возраст | n | Движение | Прикосновение | Укол |
|---|---|---|---|---|
| <21 | 9 | 5.2 ±4.8 |
24.8 ±25.3 |
25.4 ±24.3 |
| 21-30 | 54 | 8.2 ±7.6 |
14.1 ±18.5 |
13.6 ±13.9 |
| 31-40 | 60 | 5.7 ±7.3 |
12.0 ±14.4 |
13.2 ±11.8 |
| 41-50 | 34 | 8.3 ±8.8 |
15.5 ±14.3 |
17.2 ±14.3 |
| >50 | 14 | 8.6 ±8.0 |
13.9 ±8.1 |
11.1 ±7.9 |
- Субъекты
- 171 пациент
- возраст 2-64 (в среднем 34.9) года
- 139 мужчин и 32 женщин
- от 6 месяцев до 18 лет после травмы - Проведенные операции
- Ламинэктомия
- Введение 500000 клеток фетальной OEG выше и ниже места повреждения
- Герметизация твердой мозговой оболочкой
Hungyun Huang и его коллеги недавно опубликовали статью в Китайском Медицинском Журнале (2003, 116:1488-91), обобщив результаты лечения первых 171 пациентов, которым они пересадили клетки OEG. Больные были в возрасте от 2 до 64 лет, преимущественно мужского пола (139 мужчин и 32 женщин), от 6 месяцев до 18 лет после травмы (в среднем 2 года). Клетки получали из обонятельной луковицы человеческих плодов, полученных при медицинских абортах. Спинной мозг выше и ниже места повреждения был обнажен путем ламинэктомии. Приблизительно по полмиллиона клеток вводили выше и ниже места повреждения. В таблице приведены средние показатели улучшения двигательной функции, тактильной и болевой чувствительности у больных через 4-6 недель после трансплантации в каждой возрастной группе. Приблизительно 71% пациентов были отнесены в группу А по шкале ASIA (полное SCI). Не было никакого значимого различия в восстановлении между возрастными группами.
Другие клинические исследования SCI
- Клиническое испытание NIH, оценивающее эффективность тренировки ходьбы на тредмилле с поддержанием веса тела для реверсии феномена "learned non-use"
- Стимуляция сегмента L2 спинного мозга для активизации генератора локомоторного паттерна (Hermann в Таксоне и Dimitrijevic в Вене)
- Экспериментальные хирургические методы
- Трансплантация фетальных стволовых клеток (Москва, Новосибирск, Пекин)
- Соединение периферических нервов со спинным мозгом (Brunelli, Brescia)
- Соединение периферических нервов с мочевым пузырем и мышцами (Zhang в Шанхае)
- Перемычки из периферических нервов в месте повреждения спинного мозга и коктейль из факторов роста (Cheng в Тайване)
- Устранение фиксации спинного мозга, трансплантация периферических нервов и сальника, гипербарическая оксигенация и 4-аминопиридин (Carl Kao в Эквадоре)
- Трансплантация сальника (США, Куба, Китай и Италия)
- Эмбриональные трансплантаты акулы (Tijuana)
Ряд других клинических исследований проводится в настоящее время. Тренировка ходьбы на тредмилле с поддержанием веса тела улучшает локомоторное восстановление больных с хроническим SCI. Клинические испытания, подтверждающие это, проводятся в нескольких европейских странах (Швейцария, Германия, Бельгия, и др.) и Соединенных Штатах. Тренировка, несомненно, приводит к реверсии "learned non-use".
Около двух лет назад Hermann с соавт. в Таксоне (США) и Dimitrijevic в Вене (Австрия) показали, что стимуляция спинного мозга на уровне L2 способна активизировать у человека генератор локомоторного паттерна. Такая подпороговая активизация генератора локомоторного паттерна не только может запустить рефлексы передвижения, но, оказывается, облегчает произвольную локомоторную активность у больных с хроническим SCI. Наконец, целый ряд спорных экспериментальных хирургических операций пытаются проводить во многих странах. В их число входят трансплантация сальника, стволовых клеток костного мозга, фетальных стволовых клеток, соединение периферическими нервами рассеченного спинного мозга, соединение периферическими нервами спинного мозга выше места повреждения с парализованными мышцами и даже применение эмбриональных трансплантатов акулы.
Планируемые клинические испытания
- IN-1 (антитела к Nogo) - Novartis
- Блокаторы Nogo-рецепторов - Biogen
- IgM-каппа-антитела - Acorda
- Инозин - Boston Life Science
- Цетрин (rho-ингибитор C3) - BioAxone
- Стволовые клетки костного мозга - Neuronyx
- Фетальные стволовые клетки - Okano и соавт., Университет Keio
- Стволовые клетки пуповинной крови - Stemcyte
- Хондроитиназа АВС - Acorda Therapeutics, Seikagaku и др.
- Глиальный нейротрофический фактор (GDNF) - Amgen в Сан-Диего
- Эритропоэтин - Johnson & Johnson
Планируется целый ряд клинических испытаний. IN-1 (новые антитела, описанные Martin Schwab) лицензированы и разрабатываются Novartis. Блокаторы Nogo-рецепторов были обнаружены Stephen Strittmatter и лицензированы Biogen. Moses Rodriguez в Клинике Mayo обнаружил IgM-каппа антитела, способствующие ремиелинизации и регенерации. Larry Benowitz из Гарварда установил, что инозин стимулирует регенерацию кортикоспинального тракта и Бостонская Life Sciences Inc. лицензировала эту технологию. Almudena Ramon-Cuetos в Мадриде завершила исследования на обезьянах и показала, что аутологичная обонятельная оболочечная глия может быть выделена из обонятельных луковиц взрослых и пересажена в спинной мозг. Lisa McKerracher в Монреале обнаружила, что C3 и другие rho-ингибиторы могут заблокировать эффекты Nogo.
Финансируемый NIH в Университете Tulane Центр изучения стволовых клеток, возглавляемый Darwin Prockop, собирается начать клиническое испытание трансплантации стволовых клеток костного мозга при SCI. Д-р Okano в Университете Keio завершил исследования на обезьянах по трансплантации фетальных стволовых клеток. Первая фаза клинических испытаний стволовых клеток пуповинной крови должны начаться в нескольких центрах США. Несколько компаний, включая Acorda Therapeutics, работают над хондроитиназой АВС. Глиальный нейротрофический фактор (GDNF) уже испытывается для лечения болезни Паркинсона и может быть испытан при SCI (Amgen). Эритропоэтин сейчас планируется для клинических испытаний (Johnson & Johnson).
Поколения SCI терапии
- Терапия первого поколения
- 4-Аминопиридин (Acorda)
- Стимуляторы роста
- GM1 (Fidia)
- AIT-082 (Neotherapeutics)
- переменный электрический ток (Purdue)
- Клеточные трансплантаты
- Трансплантаты фетального спинного мозга (UFG)
- Макрофаги (Proneuron)
- Фетальные стволовые клетки: свиней (Diacrin), человека (Россия, Китай)
- Трансплантаты периферических нервов (Тайвань)
- Обонятельная оболочечная глия (Пекин), аутотрансплантаты слизистой носа (Лиссабон), культивированная назальная OEG (Брисбен)
- Нейротрофин-секретирующие фибробласты
- Локомоторная тренировка
- Тренировка ходьбы на тредмилле с поддержанием веса тела (Бонн, Цюрих, Лос-Анджелес и др.)
- Локомоторная функциональная электростимуляция (Аризона, Вена)
- Терапия второго поколения
- Иммунная терапия
- M1 антитела (Acorda)
- Кополимер Копаксон (Teva)
- Блокаторы ингибиторов роста
- IN-1 человека (Novartis)
- Rollipram (ингибитор PDE-4)
- Rho-ингибитор C3 (BioAxone)
- Хондроитиназа АВС (Seikagaku)
- блокаторы Nogo-рецепторов (Biogen)
- Факторы роста
- Нейротрофин (Регенерон)
- Инозин (BLSI)
- Нейрорегулины (Acorda)
- Клеточные трансплантаты (см. ниже)
- Стволовые клетки костного мозга
- Стволовые клетки пуповинной крови
- Генетически модифицированные стволовые клетки
- Кишечные глиальные стволовые клетки
- Иммунная терапия
В настоящее время около дюжины видов терапии первого поколения находятся в клиническом испытании. Некоторые из них могут оказаться эффективными, другие нет. Я верю, что одна или несколько из этих методик позволят восстановить функции у некоторых больных SCI. Методы лечения второго поколения будут опробованы в недалеком будущем и должны восстанавливать больше функций у большего числа людей. Почти все эти методы улучшают функциональное восстановление у животных. Ясно, что есть много возможных терапевтических факторов, и из разделение на первое и второе поколение носит условный характер. Что станет "терапией второго поколения", очевидно, зависит от результатов клинических испытаний первого поколения.
Терапия третьего поколения
- Комбинированная терапия
- Регенеративная
- Шунтирование места повреждения
- Факторы роста
- Подавление ингибиторов роста
- Направление аксонов к цели
- Ремиелинизирующая
- Стимулирование ремиелинизации
- Ремиелинизация с помощью шванновских клеток, OEG, O2A, эмбриональных стволовых клеток
- Восстановительная
- 4-аминопиридин
- Biofeedback-терапия (терапия с использованием обратной биологической связи)
- Лечение принудительным использованием
- Индуцированная активностью пластичность спинного мозга
- Регенеративная
- Новые виды терапии
- Вакцины
- Регенеративные вакцины
- Нейропротективные вакцины
- Ремиелинизирующие вакцины
- Стволовые клетки
- Нейрональное замещение
- Реверсия атрофии
- Замещение мотонейронов
- Генная терапия in vivo
- Генная терапия, направленная на выработку нейротрофинов и других факторов роста
- Молекулы клеточной адгезии, направляющие рост аксонов
- Вакцины
Терапия третьего поколения, вероятно, будет включать комбинации регенеративных, ремиелинизирующих и восстановительных методов лечения. Рассматриваются некоторые, действительно, новые виды терапии, включающие терапевтические вакцины, замещение стволовыми клетками погибших нейронов и средства управления аксональным ростом. Эти методы даже не снились ученым в 1995 году, поскольку никто не мог заставить животных производить свои собственные антитела для стимуляции нейропротекции, регенерации и ремиелинизации. Плюрипотентные стволовые клетки были недоступны в 1995, и первые человеческие стволовые клетки были выращены в культуре в 1997 г. Наконец, хотя концепция генной терапии появилась около 1995 года, не было инструментальных средств для генной терапии in vivo. Вероятные гены включают нейротрофины и другие факторы роста, молекулы клеточной адгезии.
Источники стволовых клеток
- Эмбриональные стволовые клетки
- Оплодотворенные in vitro яйцеклетки
- Клонированные яйцеклетки
- Партеногенетические яйцеклетки
- Фетальные стволовые клетки
- Фетальные нервные стволовые клетки
- Эмбриональные клеточные линии стволовых клеток
- Многие другие ткани зародышей содержат большое количество стволовых клеток.
- Пуповина
- Неонатальная кровь
- Плацента, пупочная вена
- Стволовые клетки взрослого
- Нервные стволовые клетки
- Гиппокамп
- Обонятельная луковица
- Спинной мозг
- Мезенхимальные стволовые клетки
- Стволовые клетки костного мозга
- Стволовые клетки слизистой носа
- Периферическая кровь
- Кожа и другие органы
- Кишечная глия (аппендикс)
- Нервные стволовые клетки
Замещение погибших клеток особенно важно при повреждениях спинного мозга, которые затрагивают серое вещество. Клетки могут погибнуть непосредственно при травме, из-за вторичного некроза, апоптоза, кистозной дегенерации и при длительном нефункционировании. Стволовые клетки могут заменить утраченные нейроны. Есть много источников стволовых клеток. Наиболее известный и широко изученный - фетальные стволовые клетки. Это клетки, полученные при прерывании беременности от плодов человека (с 6 недель до рождения). Методы выделения и выращивания эмбриональных стволовых клеток человека были разработаны в 1997 году, но исследование в Соединенных Штатах идет медленно. В пуповинной крови содержится множество плюрипотентных стволовых клеток. У взрослых стволовые клетки обнаружены во многих частях тела, особенно, в головном и спинном мозге. Последние исследования свидетельствуют, что костный мозг, слизистая носа, периферическая кровь, кожа, жир и даже зубы детей содержат плюрипотентные мезенхимальные стволовые клетки. В кишечнике также есть стволовые клетки (кишечная глия).
Стволовые клетки
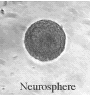 |
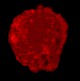 |
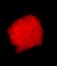 |
 |
| Нейросфера | Окраска на нестин | Окраска BRDU |
Это микрофотографии стволовых клеток, выделенных из мозга новорожденных. Вверху слева - нейросфера, являющаяся наиболее частой формой, которую принимают стволовые клетки, растущие на не содержащей сыворотки среде с основным фактором роста фибробластов. Эта нейросфера окрашена на нестин (простое волокно, часто вырабатываемое стволовыми клетками) и BRDU (краситель для выявления митоза). Когда нейросфера помещается в культуре с сывороткой, клетки начинают дифференцироваться, сцепляться и вырастать за границы сферы.
Принципы восстановления
- "Полное" повреждение спинного мозга не означает его перерыва
- Разрыв или трансекция спинного мозга встречается очень редко
- <10% аксонов могут обеспечить существенное функциональное восстановление - Ускорение и расширение процессов восстановления
- Восстановление продолжается при хроническом SCI в течение многих лет
- У некоторых людей может произойти спонтанная регенерация - Выжившие и регенерирующие аксоны должны быть миелинизированы
- 4-аминопиридин улучшает проводимость
- Клеточная трансплантация ремиелинизирует аксоны - Спинной мозг обладает значительной "пластичностью"
- Точное воссоединение не обязательно
- Локальное прорастание через срединную линию может восстановить функции - Реверсия феномена "learned non-use" ("разучился использовать")
- Даже короткий период бездеятельности может выключить нервные цепи
- Интенсивные упражнения с "принудительным использованием" могут восстановить функцию
Можно выделить следующие принципы восстановления функций поврежденного спинного мозга. "Полное" повреждение спинного мозга не означает трансекции. Разрыв или трансекция спинного мозга с отделением двух его концов - явление очень редкое. Даже небольшого количества ткани, проходящей через место повреждения, может быть достаточно, чтобы поддержать 10% аксонов и обеспечить существенное функциональное восстановление. Многие люди восстанавливают двигательную и сенсорную функцию через годы после травмы. Поскольку у некоторых из них восстановление происходит так поздно, это свидетельствует о возможности спонтанной регенерации, хотя и очень медленной. Выжившие и регенерирующие аксоны должны быть миелинизированы. Мы должны помнить, что аксонам, чтобы функционировать, нужен миелин. Спонтанная ремиелинизация, конечно, может произойти. Для ее стимуляции можно применить 4-аминопиридин. Большинство ученых допускают, что аксоны прорастают через место повреждения и достигают области своего изначального приложения, где могут соединяться с соответствующими нейронами, поскольку и головной, и спинной мозг являются достаточно "пластичными", чтобы образовать новые связи. Наконец, так как лежащие ниже места травмы отделы спинного мозга многих больных с хроническим SCI не функционировали довольно долго, может быть необходима интенсивная тренировка, чтобы устранить феномен "learned non-use" уже после регенеративной и ремиелинизирующей терапии.
Подготовка к восстановлению
- Избегать лишних необратимых хирургических операций, например:
- Ризотомии дорзальных корешков, трансекции спинного мозга
- Хирургии, жертвующей крупными периферическими нервами
- Предотвратить мышечную и костную атрофию
- Дозировать антиспастические препараты, например, баклофен так, чтобы устранить спастичность не полностью.
- Выполнять упражнения по стоянию и ходьбе
- Использовать функциональную электрическую стимуляцию (FES), чтобы сохранить и укрепить мышцы
- Устранить факторы, продолжающие повреждать спинной мозг
- Декомпрессия
- Устранение фиксации спинного мозга
- Уменьшение сирингомиелических кист
- Реверсия "learned non-use"
- Физический терапия
- Индуцированная активностью пластичность спинного мозга
- Плавание и гидротерапия
- Тренировка ходьбы на тредмилле с поддержанием веса тела
- Biofeedback-терапия (терапия с использованием обратной биологической связи)
- Стимуляция сегмента L2 спинного мозга для активизации генератора локомоторного паттерна
Наиболее частый вопрос больных с травмой спинного мозга - как они могут подготовиться к восстановлению. Во-первых, необходимо избегать излишних и необратимых хирургических операций. Например, некоторые хирурги рекомендуют рассечение спинномозговых корешков (ризотомию) и даже спинного мозга, чтобы устранить спастичность и нейропатическую боль. Также важно избегать операций, жертвующих крупными периферическими нервами. Во-вторых, предотвратить мышечную и костную атрофию. Дозировать антиспастические препараты так, чтобы небольшая спастичность оставалась. Спастичность помогает поддерживать мышцы в форме. Выполнять упражнения по стоянию и ходьбе. Использовать функциональную электрическую стимуляцию (FES), чтобы сохранить и укрепить мышцы. В-третьих, устранить факторы, продолжающие повреждать спинной мозг, включающие сдавление, фиксацию и сирингомиелические кисты. Наконец, устранение "learned non-use". Необходимы регулярные физические упражнения, плавание, тренировка ходьбы на тредмилле с поддержанием веса тела, biofeedback-терапия и даже стимуляция сегмента L2 спинного мозга для активизации локомоторной деятельности, когда она становится возможной.
Заключение
- В 1995 г. только один вид терапии (метилпреднизолон) улучшал восстановление после повреждения спинного мозга.Некоторые методики показали многообещающие результаты в лабораторных исследованиях.
- За прошедшие восемь лет достижения в хирургическом и медикаментозном лечении SCI были поистине революционными.
- Интенсивная тренировка может улучшить локомоторное восстановление.
- Некоторые клинические испытания показали ограниченные результаты (фетальные трансплантаты спинного мозга, GM1), но другие проводящиеся в настоящее время, испытания могут дать положительные результаты (4-AP, OEG, переменный ток)
- Многие методы регенеративной и ремиелинизирующей терапии, улучшающие функциональное восстановление у животных, начали или скоро начнут испытываться в клинике.