Медицинская реабилитация
12. Основы нейроэндокринной регуляции функций
Эндокринные железы или железы внутренней секреции выделяют в кровь химические вещества, предназначенные для передачи сигнала другим клеткам; эти вещества называются гормонами. Нервные клетки, как известно, тоже используют химические вещества для передачи сигналов. Разница здесь в том, что нейроны могут действовать только на такие клетки, которые образуют синапсы с его аксоном, а поэтому действие нейромедиаторов оказывается точным и быстрым. Гормоны поступают в общий кровоток и поэтому способны повлиять на многие клетки, лишь бы они имели специфические рецепторы для связывания молекул гормона. Таких клеток-мишеней может быть много и они могут находиться в разных тканях и органах.
Некоторые вещества, хорошо известные в качестве нейромедиаторов, например норадреналин, тоже могут попадать в кровь, и в таких случаях они действуют как гормоны. И нервная, и эндокринная системы регулируют обменные процессы в организме, а их активность координирует общий для обеих систем высший центр – гипоталамус. Секреция некоторых гормонов (например, инсулина или тестостерона) может изменяться под влиянием нейромедиаторов.
Всё это даёт основание говорить о единой нейроэндокринной системе регуляции.
В классической эндокринологии считалось, что гормоны образуются лишь в железах внутренней секреции (гипофиз, надпочечники, щитовидная, околощитовидные, поджелудочная, вилочковая и половые железы – рис. 12.1).
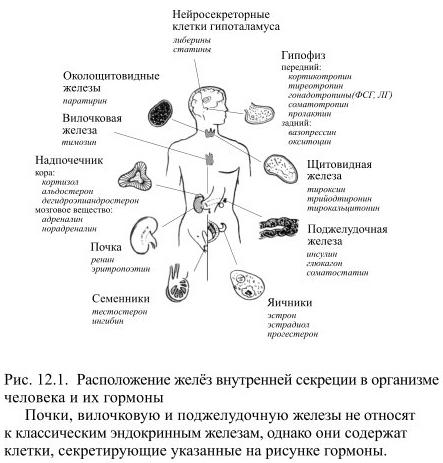
В настоящее время гормонами считают все выделяемые в кровь вещества, если они способны специфически действовать на другие клетки. Такие вещества могут секретироваться не только специальными органами, но и группами клеток и даже отдельными клетками. В связи с этим список гормонов за последнее время существенно увеличился: к ним относят более 60 химических соединений.
12.1. Происхождение, секреция, транспорт и действие гормонов
В зависимости от химической структуры гормоны подразделяются на три группы: 1) производные аминокислот; 2) белки и пептиды; 3) стероиды. К производным аминокислот относятся гормоны мозгового вещества надпочечников адреналин и норадреналин, образующиеся там из тирозина, а также гормоны щитовидной железы тироксин и 3-йодтиронин, синтезирующиеся путём йодирования всё того же тирозина. Белковую природу имеют все гормоны передней доли гипофиза, гормоны поджелудочной железы инсулин и глюкагон, гормоны околощитовидных желёз; к пептидам относятся выделяемые в задней доле гипофиза вазопрессин и окситоцин. Стероидные гормоны образуются из молекулы холестерина: это гормоны коры надпочечников (кортизол, кортикостерон, альдостерон, дегидроэпиандростерон) и половых желёз (андрогены и эстрогены).
Образование гормонов из тирозина и холестерина происходит в несколько этапов, каждый из которых контролируют специальные ферменты, чей синтез обусловлен генетически. Белковые и пептидные гормоны, так же в несколько этапов, образуются из крупных белковых молекул прегормонов, причём их аминокислотную последовательность контролируют одни гены, а программу превращения в конечную форму – другие. Некоторые пептидные гормоны могут образовываться разными способами в результате ферментативного расщепления различных предшественников. В большинстве секретирующих клеток запасы гормонов очень невелики и лишь некоторые из них содержат специальные гранулы, в которых хранится запасённый продукт. Поэтому в кровь путём экзоцитоза или просто диффузии чаще всего поступают только что образованные молекулы. Выделение некоторых гормонов увеличивается или уменьшается в зависимости от времени суток (например, выделение соматотропина из передней доли гипофиза повышается в ночные часы), оно может зависеть от возраста и от эмоционального состояния. Некоторые гормоны, как, например, лютеинизирующий гормон передней доли гипофиза или мужской половой гормон тестостерон поступают в кровь путём пульсирующей секреции, которая происходит в течение 1-2 минут и неоднократно повторяется на протяжении суток (вследствие такого характера секреции уровень гормона в крови периодически изменяется).
Некоторые гормоны могут поступать к месту действия через лимфу или через внеклеточную жидкость, но большинство из них выделяются в кровь. Большинство пептидных гормонов, а также катехоламины там растворяются, тогда как стероидные гормоны и тиреоидные гормоны щитовидной железы связываются с транспортными белками, причём, чем меньше гормон растворим в воде, тем важнее роль этих белков.
Током крови гормоны могут быть доставлены к разным клеткам, но подействовать они способны лишь на те из них, что имеют специальные рецепторы для присоединения молекул гормона. Эти рецепторы находятся либо на клеточной мембране, либо в цитоплазме, либо в клеточном ядре. Рецепторы для гормонов, которые не могут пройти через клеточную мембрану (белковые и пептидные гормоны, а также катехоламины) обычно находятся на поверхности клеточной мембраны. После присоединения к ним молекул гормонов происходит образование вторичных посредников (таких, например, как цАМФ или кальций-кальмодулин), которые изменяют активность ферментов клетки, что, в свою очередь, вызывает направленные изменения обменных процессов в клетке и связанные с ними физиологические проявления.
Стероидные и тиреоидные гормоны, освободившись от транспортных белков, диффундируют через клеточную мембрану (в клетке некоторые из них превращаются в более активную форму: тестостерон в дигидротестостерон, тироксин в 3-йодтиронин) и присоединяются к специфическим рецепторным белкам цитоплазмы, образуя комплекс гормон-рецептор. Некоторые стероиды и 3-йодтиронин образуют такой комплекс с рецепторами, расположенными в клеточном ядре. После активации такие гормон-рецепторные комплексы присоединяются к хроматину и вызывают экспрессию определённых генов, что приводит к синтезу новых ферментов и, соответственно, длительному изменению обменных процессов в клетках и характерным физиологическим сдвигам
12.2. Регуляция образования гормонов
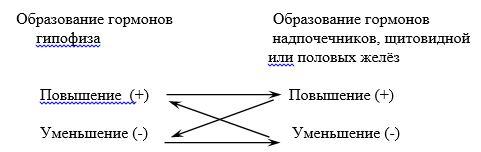
Концентрация гормонов в крови может изменяться в зависимости от скорости их образования. Существуют специальные сенсорные механизмы, которые следят либо за уровнем самого гормона в крови (1), либо за уровнем, регулируемых этим гормоном гомеостатических констант (2). При отклонении соответствующего параметра в сторону повышения или понижения происходит уменьшение или увеличение секреции гормона – это регуляция по принципу обратной связи. Например, повышение в крови уровня образующегося в коре надпочечников кортизола уменьшает выделение из гипофиза кортикотропина, который стимулировал секрецию кортизола. В результате снижения продукции кортикотпропина выделение кортизола из надпочечников уменьшается и соответственно нормализуется уровень этого гормона в крови. Пониженный уровень кортизола приводит к увеличению образования кортикотропина, он стимулирует деятельность коры надпочечников, выделение кортизола в кровь повышается. По такому же принципу гипофиз взаимодействует со щитовидной и половыми железами: при высоком уровне их гормонов в крови в гипофизе уменьшается синтез тропных гормонов (соответственно тиреотропного и гонадотропных), а низкий уровень тироксина или половых стероидов, наоборот, ведёт к увеличенной секреции тиреотропного или гонадотропных гормонов:
Если же секреция гормонов зависит от управляемого параметра, как, например, в случае образования гормонов поджелудочной железы, контролирующих уровень глюкозы в крови, то схему регуляции можно изобразить так:
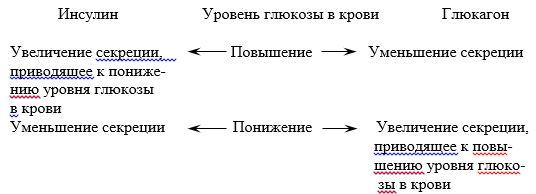
По такой же схеме регулируется продукция двух гормонов, контролирующих уровень кальция в крови: тирокальцитонин выделяется особыми клетками щитовидной железы в большем количестве, если нужно понизить уровень кальция в крови, а когда кальция в крови становится мало, активируется образование паратгормона в околощитовидных железах: и в том, и в другом случае результатом изменения секреции гормонов будет нормализация уровня кальция в крови. Регуляция по принципу обратной связи осуществляется быстро: темп секреции того или иного гормона может измениться уже за несколько минут, благодаря чему константы гомеостаза удерживаются в относительно узких пределах.
12.3. Роль гипоталамуса в регуляции образования гормонов передней доли гипофиза (гипоталамо-аденогипофизарная система)
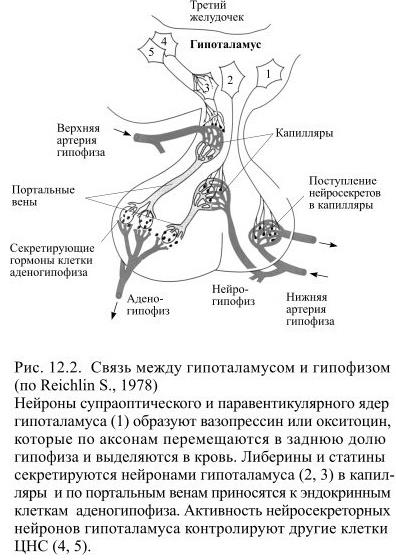
В 1928 году Эрнст и Берта Шаррер (Scharrer E. B.) впервые обнаружили явление нейросекреции – способность нервных клеток синтезировать и выделять определённые вещества. Дальнейшие исследования позволили создать концепцию, согласно которой некоторые нейроны могут действовать как нейроэндокринные преобразователи, трансформирующие кратковременные нервные импульсы в длительные гуморальные влияния на ткани организма. В 1955 году Джеффри Харрис (Harris G.) сумел объяснить назначение необычной сосудистой связи между гипоталамусом и гипофизом, получившей название портальной (т.е. воротной) системы. Густая сеть капилляров гипоталамической области собирается в т.н. портальные вены, они доставляют кровь к передней доле гипофиза, где снова распадаются на множество мелких капилляров (Рис.12.2). Харрис, на основе проведённых экспериментов, показал, что продукты нейросекреции клеток гипоталамуса доставляются по портальной системе в аденогипофиз (передняя доля гипофиза, состоящая из железистой ткани) и регулируют образование его гормонов.
Химическую природу нейросекретов, выделяющихся в чрезвычайно малом количестве, удалось обнаружить лишь в 1969 сразу двум группам исследователей, которыми руководили Роже Гиймен (Guilleman R.) и Эндрю Шелли (Schally A.), получившие за это открытие Нобелевскую премию в 1977 году. Выделяемые сравнительно небольшими, т.н. парвоцеллюлярными гипоталамическими нейронами вещества оказались пептидами, одни из которых стимулировали, а другие тормозили образование гормонов передней доли гипофиза.

Первые из них назвали либеринами или рилизинг-гормонами (от лат. libero или англ. release – освобождать), а вторые – ингибирующими гормонами или статинами. Известные к настоящему времени либерины и статины представлены в таблице 12.1 вместе с гормонами аденогипофиза, на образование которых они влияют.
Следует отметить, что соматостатин тормозит ещё и продукцию тиреотропина, а тиреотропин-либерин стимулирует секрецию пролактина, тогда как тормозит её не нейросекрет, а хорошо известный нейротрансмиттер дофамин.
Чтобы понять функциональный смысл взаимоотношений гипоталамуса и гипофиза, следует сопоставить два обстоятельства. Во-первых, в гипоталамус, как уже рассматривалось в главе 11, поступает необходимая информация о состоянии гомеостаза и внутренних органов, он имеет двусторонние связи с различными подкорковыми структурами и корой, что позволяет ему координировать всю регуляцию вегетативных функций. Во-вторых, передняя доля гипофиза – классическая железа внутренней секреции, образованная несколькими разновидностями железистых клеток, она выделяет гормоны, которые контролируют деятельность других важнейших эндокринных желёз: коры надпочечников (кортикотропин), щитовидной (тиреотропин) и половых. (два гонадотропных гормона: лютеотропин и фоллитропин). Ещё два гормона гипофиза – соматотропин и пролактин также играют важную роль в эндокринной регуляции функций. Таким образом, выделяя в капилляры портальной системы свои нейросекреты – гипофизотропные гормоны, гипоталамус держит под контролем большинство желёз внутренней секреции. Однако отношения между гипоталамусом и гипофизом не следует рассматривать, как улицу с односторонним движением: повышение в крови уровня гипофизарных гормонов и гормонов зависимых от него желёз заставляет гипоталамус уменьшать секрецию либеринов и/или увеличивать выделение статинов.
12.4. Физиологическая роль гормонов аденогипофиза
Как уже было сказано, четыре гормона аденогипофиза предназначены для регуляции деятельности других желёз внутренней секреции, поэтому их называют тропными. Эти гормоны секретируются в общий кровоток, но действуют либо на кору надпочечников (кортикотропин), либо на щитовидную железу (тиреотропин), либо на половые железы (лютеотропин и фоллитропин), поскольку только клетки этих желёз имеют необходимые рецепторы для связывания соответствующих гормонов.
Соматотропин (соматотропный гормон – СТГ) или гормон роста действует на большинство тканей, изменяя в них характер обменных процессов. В растущем организме он необходим для нормального линейного роста: при недостатке соматотропина наблюдается низкорослость, а при его избытке – гигантизм. Он стимулирует включение аминокислот во вновь образующиеся белки, а такой процесс обновления белковых структур должен происходить в любом возрасте. Поскольку соматотропин способствует белковому синтезу, его называют анаболическим гормоном. Для синтеза белка необходима энергия и соматотропин обеспечивает её поступление, стимулируя расщепление жиров и углеводов – в результате в крови повышается уровень глюкозы. Одновременно с этим он может препятствовать выделению из внутрисекреторных клеток поджелудочной железы инсулина, который понижает уровень глюкозы: этот контринсулярный эффект позволяет говорить о диабетогенном действии соматотропина. Действие соматотропина на ткани скорее всего непрямое, оно опосредовано соматомединами – это похожие на молекулу инсулина белки, которые образуются в печени под влиянием гормона роста и затем выделяются в кровь.
В норме большая часть гормона роста выделяется в ночные часы. К повышению его секреции приводят многие физиологические стимулы. Это гипогликемия (снижение уровня глюкозы в крови), которая появляется, например, при голодании, это интенсивная физическая работа и некоторые виды стресса. Секреции соматотропин-либерина в гипоталамусе способствуют дофамин и серотонин. Гормоны коры надпочечников кортизол и кортикостерон угнетают секрецию гормона роста.
Ещё один гипофизарный гормон – пролактин необходим для лактации, т.е. образования молока у кормящей матери. Кроме молочных желёз рецепторы для этого гормона содержатся в половых железах, у животных они найдены и во многих других тканях. Секреции пролактина препятствуют дофаминэргические нейроны гипоталамуса, их тормозное влияние усиливается при повышении концентрации пролактина в крови. При кормлении грудью секреция пролактина увеличивается под влиянием либерина, о котором пока нет единого мнения, поскольку известно несколько веществ с таким действием, а именно: тиреотропин-либерин, вазоактивный интестинальный пептид (ВИП), ангиотензин II и b-эндорфин. По-видимому, при раздражении механорецепторов соска во время кормления происходит афферентная импульсация к гипоталамусу, которая и вызывает повышенное образование всех этих веществ или, по крайней мере, одного из них. Образование и выделение пролактина стимулирует также повышение в крови уровня эстрогенов – женских половых гормонов.
Физиологическая роль этого гормона в мужском организме не выяснена, известно лишь, что содержание пролактина в крови мужчин примерно на 1/4 меньше, чем у некормящих женщин, а избыток пролактина у мужчин способствует импотенции и бесплодию.
12.5. Гипоталамус и гормоны нейрогипофиза
Нейрогипофизом называют его заднюю долю, которая образована окончаниями очень крупных (магноцеллюлярных) нервных клеток, находящихся в супраоптическом и паравентрикулярном ядрах гипоталамуса. В телах таких нейронов происходит синтез гормонов (вазопрессина и окситоцина), доставляемых аксонным транспортом к нервным окончаниям, а оттуда гормоны выделяются в кровь. Одни магноцеллюлярные клетки синтезируют вазопрессин, другие – окситоцин. Это небольшие пептиды, образованные всего лишь девятью аминокислотными остатками и различающиеся между собой по двум из этих остатков. Чем чаще возбуждаются магноцеллюлярные клетки гипоталамуса, тем больше гормонов будет поступать в кровь в нейрогипофизе.
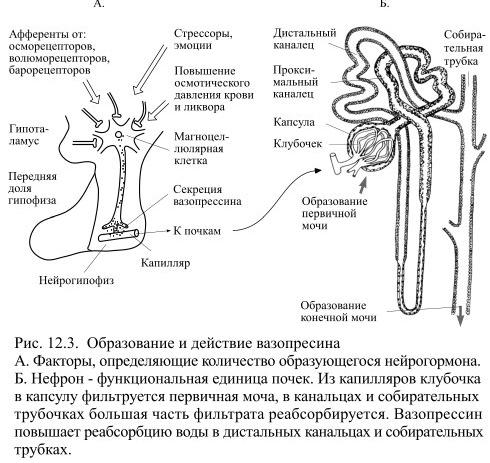
Вазопрессин получил своё название в связи с обнаружением его сосудосуживающего действия. Однако такое действие он оказывает лишь при патологически высокой концентрации в крови. При нормальной концентрации он действует преимущественно на дистальные канальцы и собирательные трубочки нефронов почек (Рис.12.3).
При образовании мочи из кровеносных капилляров, образующих клубочки нефронов, фильтруется огромное количество жидкости (до 180 литров в сутки у взрослых людей). Большая часть фильтрата в канальцах нефрона и собирательных трубочках путём реабсорбции (обратного всасывания) возвращается в кровоток, поэтому объём выделяющейся конечной мочи за сутки (суточный диурез) составляет от 1 до 2 литров. Под действием вазопрессина реабсорбция воды в почках увеличивается и соответственно уменьшается диурез. Такое действие вазопрессина послужило основанием для ещё одного его названия – антидиуретический гормон.
Основным стимулом для повышенной секреции вазопресссина является увеличение осмотического давления крови и ликвора, что чаще всего происходит из-за нарастающей концентрации солей натрия. На этот сдвиг реагируют осморецепторы самих клеток гипоталамуса, а также кровеносных сосудов, доставляющих кровь от кишечника к печени. При поступлении такой информации от осморецепторов нейроны гипоталамуса увеличивают секрецию вазопрессина, который повышает реабсорбцию воды в почках. Задержанная вода разбавляет соли в жидкостях организма и уменьшает осмотическое давление. При уменьшении осмотического давления ниже нормы секреция вазопрессина понижается и тогда реабсорбция воды в почках становится меньше. В связи с её повышенным выведением концентрация солей в крови увеличивается, что приводит к выравниванию осмотического давления.
Секреция вазопрессина зависит ещё и от объёма жидкости в кровяном русле: при его увеличении образование гормона уменьшается, а при малом объёме – увеличивается. В первом случае мочи будет выделяться больше, во втором – меньше, а в результате объём остающейся в кровяном русле жидкости выравнивается до нормального значения. Информация об объёме жидкости в кровяном русле поступает в гипоталамус по афферентным путям от особой разновидности механорецепторов, находящихся в левом предсердии и, по-видимому, в лёгочных венах, впадающих в это предсердие. При увеличении объёма крови они растягиваются больше обычного, что вызывает повышение частоты сигналов от находящихся в этих областях волюморецепторов – так называется эта разновидность механорецепторов.
Помимо этого на количество выделяющегося вазопрессина влияет афферентная информация от барорецепторов дуги аорты и сонных артерий. При понижении артериального давления частота импульсации от этих рецепторов уменьшается, что приводит к увеличению секреции вазопрессина. Он задерживает воду в почках, а это приводит к увеличению объёма жидкости в сосудистом русле и связанному с этим обстоятельством повышению давления.
При психоэмоциональном стрессе и при болевом шоке продукция вазопрессина увеличивается, в этих случаях действие различных нервных структур на гипоталамус скорее всего опосредовано холинэргическими волокнами, хотя b-адренэргические стимулы также приводят к повышенному образованию вазопрессина. Его продукцию угнетает алкоголь, что закономерно приводит к увеличению диуреза.
Второй гормон нейрогипофиза – окситоцин действует преимущественно на гладкие мышцы матки и способные к сокращению миоэпителиальные клетки, располагающиеся вокруг альвеол молочных желёз. Чувствительность гладких мышц матки к окситоцину резко повышается в конце беременности. При растяжении матки от её механорецепторов к гипоталамусу идут по афферентным путям соответствующие сигналы, что стимулирует выделение окситоцина. Во время родов он способствует сокращениям гладких мышц матки и изгнанию плода. Во время кормления грудью образование окситоцина стимулируется механическим раздражением соска и околососкового поля, что даже послужило поводом для использования термина: "рефлекс выделения молока". Образующийся при таких обстоятельствах окситоцин стимулирует сокращения миоэпителиальных клеток молочных желёз и поступление молока из секреторной ткани в сосок.
Роль окситоцина в мужском организме пока не выяснена.
12.6. Гормоны мозгового вещества надпочечников и симпатоадреналовая реакция
Находящиеся поблизости от почек парные железы – надпочечники состоят из коркового и мозгового вещества, имеющих разное происхождение и выделяющих разные гормоны. Клетки мозгового вещества по происхождению родственны ганглиям симпатического брюшного сплетения, их иннервируют симпатические преганглионарные холинэргические волокна. В мозговом веществе надпочечников образуются катехоламины: адреналин (около 80% от общего количества выделяемых гормонов), норадреналин (18%) и дофамин (2%). В состоянии покоя их выделяется сравнительно немного, но при чрезвычайных ситуациях, сопровождающихся активацией симпатического отдела, в кровь выходит большое количество катехоламинов.
Эти гормоны, особенно адреналин, стимулируют расщепление гликогена в печени и мышцах, липидов (жиров) в жировой ткани и отчасти белков в печени. В результате расщепления гликогена образуется глюкоза, уровень которой в крови начинает повышаться. Продукты расщепления липидов и белков в печени тоже преобразуются в глюкозу (её образование из неуглеводных предшественников называется глюконеогенезом). Смысл такого действия катехоламинов состоит в мобилизации энергии, освобождающейся при расщеплении углеводов, жиров и белков, а эта энергия используется для обеспечения реакций борьбы и/или бегства.
На окисление освободившейся глюкозы нужно израсходовать больше кислорода, чем обычно, а потому необходимо увеличить его доставку тканям. Эту задачу катехоламины решают путём стимуляции работы сердца: оно начинает сокращаться чаще и сильнее, что приводит к увеличению минутного объёма кровотока. Одновременно с этим суживаются сосуды внутренних органов (благодаря этому депонированная там кровь начинает работать в общем кровотоке между лёгкими и тканями) и расширяются сосуды скелетных мышц. Перераспределение кровотока в пользу работающих мышц даёт им возможность получить больше глюкозы в качестве носителя энергии и больше кислорода, необходимого для окисления.
Повышенное выделение катехоламинов из мозгового вещества надпочечников происходит одновременно с увеличенной активностью симпатического отдела вегетативной нервной системы, где медиатором является норадреналин. Выделившиеся в кровь гормоны надпочечников усиливают его действие на клетки-мишени, а кроме того они доставляются током крови к клеткам, не имеющим прямых контактов с симпатическими нейронами. Всё это послужило основанием для объединения нервного и эндокринного звена в общий механизм симпатоадреналовой реакции (Рис. 12.4).
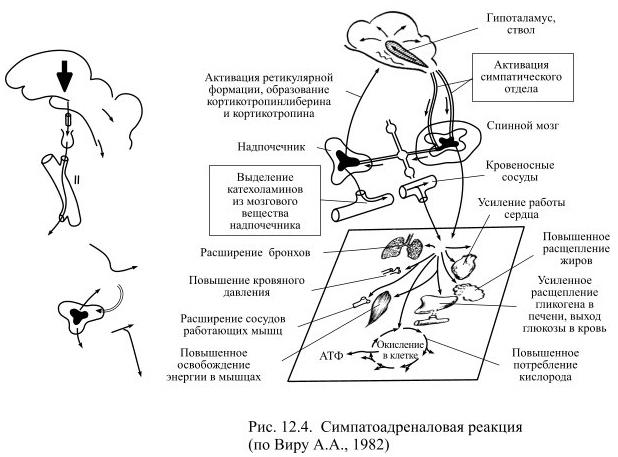
Она рассчитана на быструю мобилизацию энергоресурсов, необходимых для реакций борьбы и/или бегства, а также для приспособления к действию сильных раздражителей. Если за короткое время не удаётся ликвидировать угрозу нарушения гомеостаза, то на смену симпатоадреналовой реакции приходят механизмы стресс-реакции. Выделившиеся при симпатоадреналовой реакции катехоламины способствуют развитию стресс-реакции.
12.7. Гормоны коры надпочечников
В трёх морфологически отличающихся областях коры надпочечников из получаемого с пищей или из ранее синтезированного холестерина образуются три группы стероидных гормонов: глюкокортикоиды, минералкортикоиды и надпочечниковые андрогены (в небольшом количестве). Из каждой группы гормонов в кровь выделяется конечный продукт биосинтеза – гормон с выраженным физиологическим действием. Это глюкокортикоид кортизол, минералкортикоид – альдостерон и обладающий андрогенным действием дегидроэпиандростерон (Рис.12.5).
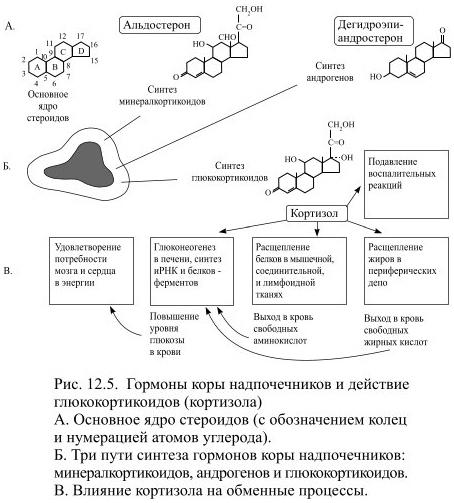
Секрецию кортизола контролирует кортикотропин (АКТГ), вырабатываемый в передней доле гипофиза. Чем больше выделяется в кровь кортикотропина (особенно много при стрессе), тем скорее синтезируется и секретируется кортизол; в свою очередь, высокий уровень кортизола в крови ведёт к уменьшению секреции АКТГ. Кортизол регулирует обмен белков, углеводов и жиров, причём его действие на разные ткани неодинаково. В мышцах, соединительной ткани, коже и костях он стимулирует катаболические процессы, т.е. расщепление белков на аминокислоты, а также тормозит там синтез нуклеиновых кислот. В печени он способствует глюконеогенезу, т.е. образованию из освободившихся аминокислот глюкозы и последующему синтезу из неё гликогена или особенно необходимых в сложившейся ситуации разновидностей белка. В жировой ткани под влиянием кортизола происходит расщепление жиров на жирные кислоты, которые также поступают в печень и в процессе глюконеогенеза превращаются в глюкозу и гликоген. Накопленные таким образом энергоресурсы и вновь образованные белки могут использоваться на нужды работающего мозга, сердечной мышцы или других органов, жизненно необходимых в конкретной ситуации, в то время как остальным тканям и органам кортизол не позволяет их получать.
Кортизол задерживает развитие воспалительных реакций, уменьшая проницаемость капилляров и освобождение расщепляющих белки ферментов в очаге воспаления – это препятствует развитию отёка. Он стимулирует выход из костного мозга фагоцитирующих чужеродные вещества нейтрофильных лейкоцитов и в то же время уменьшает содержание в крови эозинофилов и лимфоцитов, способствует перераспределению этих клеток между кровью и тканями и тормозит образование антител: тем самым кортизол изменяет характер иммунной регуляции. Кроме того, этот глюкокортикоид обладает слабым действием минералокортикоидов и поэтому влияет на распределение солей и воды в организме и на их выведение почками.
Минералкортикоид альдостерон действует на почечные канальцы, повышая там обратное всасывание ионов натрия. В результате растёт осмотическое давление в межклеточной жидкости и кровеносных капиллярах почек, что приводит к повышенной реабсорбции воды в почках и тем самым к её задержке в организме. Одновременно с этим альдостерон стимулирует выведение с мочой ионов калия и протонов. По такому же принципу, т.е. обменивая задерживаемые ионы натрия на выводимые ионы калия, альдостерон действует на потовые, слюнные железы и желудочно-кишечный тракт.
Секрецию альдостерона регулируют три механизма: система ренин – ангиотензин, концентрация ионов натрия и калия в крови и АКТГ передней доли гипофиза, причём наиболее важна ренин-ангиотензиновая система (Рис.12.6).
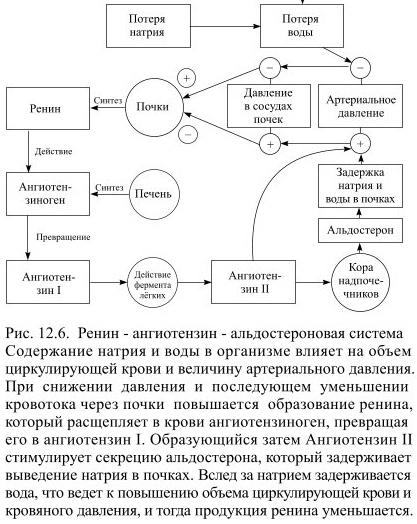
Ренин – это фермент, выделяемый в кровь специализированными клетками сосудов почек. Его образование увеличивается при уменьшении кровотока в почках (например, вследствие кровопотери). В кровяном русле ренин расщепляет ангиотензиноген (белок-глобулин, образующийся в печени). В результате появляется ангиотензин I, который затем превращается в сосудах лёгких (под влиянием специального фермента) в ангиотензин II. Ангиотензин II суживает кровеносные сосуды, повышая в них давление, – тем самым он способствует увеличению кровотока через сосуды почек, а одновременно стимулирует выделение альдостерона из коркового вещества надпочечников. Альдостерон задерживает в почках натрий, вслед за ним задерживается вода и благодаря этому восстанавливается объём циркулирующей крови, в том числе проходящей через сосуды почек.
Секреции альдостерона способствует снижение концентрации натрия и повышение концентрации калия в крови: последующее действие альдостерона на почечные канальцы ведёт к нормализации содержания этих ионов. Резко стимулирующий выделение кортизола АКТГ вызывает лишь кратковременное повышение секреции альдостерона, а затем, несмотря на присутствие АКТГ, она уменьшается.
А вот секрецию главного надпочечникового андрогена – дегидроэпиандростерона стимулирует именно АКТГ. У мужчин не менее 2/3 андрогенов образуется в семенниках и лишь оставшаяся часть происходит из надпочечников, у женщин действие этого гормона проявляется при гиперфункции надпочечников и сниженном образовании женских половых гормонов – эстрогенов. Тогда у женщин появляются вторичные половые признаки, характерные в норме лишь для мужчин: увеличение мышечной массы, уменьшение грудных желёз, рост волос на лице и теле, облысение, огрубление голоса и т.д.
12.8. Гормоны щитовидной железы
Щитовидная или тиреоидная (от греч. тиреос – удлинённый щит) железа состоит из двух долей, соединённых перешейком, который прикрывает спереди второе и третье хрящевые кольца трахеи. Прослойки соединительной ткани делят её на дольки, а секретирующие клетки образуют пузырьки или фолликулы, заполненные вязкой однородной жидкостью. В ней находится специфический белок тиреоглобулин, содержащий многочисленные остатки аминокислоты тирозина. Из хорошо развитой сети окружающих кровеносных капилляров в фолликулы проникает йод, который включается в бензольное кольцо тирозина, и в результате образуются тиреоидные гормоны: тироксин (он содержит четыре атома йода и поэтому называется ещё тетрайодтиронином) и трийодтиронин (содержит три атома йода). В кровь, путём пиноцитоза, поступает преимущественно тироксин (около 80% от общего количества), однако в тканях происходит его дейодирование – образование трийодтиронина, который и является биологически активным гормоном. Синтез и выделение тиреоидных гормонов стимулирует тиреотропин аденогипофиза.
Трийодтиронин, действуя на геном всех клеток организма, активирует синтез белка и увеличивает образование ферментов, участвующих в расщеплении углеводов. В связи с этим стимулируется рост тканей и обновление в них клеточных структур, а одновременно повышается скорость энергетического обмена. У детей тиреоидные гормоны способствуют росту тела и развитию мозга: при их недостатке наблюдается низкорослость и кретинизм – умственная недоразвитость.
Особый тип клеток щитовидной железы служит источником тирокальцитонина – гормона, регулирующего уровень кальция в крови. Наряду с ним в регуляции уровня кальция участвует паратгормон маленьких околощитовидных желёз.
12.9. Гормоны поджелудочной железы
В ткани поджелудочной железы, играющей важную роль в пищеварении, встречаются скопления эндокринных клеток, которые называются островками Лангерганса – по фамилии студента-медика, впервые обнаружившего их в 1869 году. Различают три типа таких клеток, причём каждый из них синтезирует разные гормоны: b-клетки, самые многочисленные, образуют инсулин, a-клетки – глюкагон, а d-клетки – соматостатин.
Инсулин повышает всасывание глюкозы из кишечника в кровь, а затем стимулирует транспорт глюкозы из крови в клетки печени и скелетных мышц (одновременно с этим, разумеется, снижается содержание глюкозы в крови). В клетках он активирует ферменты, превращающие глюкозу в гликоген. При накоплении в печени излишков глюкозы из неё начинают образовываться жирные кислоты, которые через кровь поступают в жировую ткань, где и хранятся. Таким образом, инсулин ведёт себя как запасливый хозяин, создающий сначала запас углеводов, а при первой представившейся возможности – и жиров. Он также обеспечивает транспорт многих аминокислот из крови в клетки и, повышая образование определённых видов РНК, стимулирует в итоге синтез белка из этих аминокислот.
Главным стимулом для образования и выделения инсулина является повышение уровня глюкозы в крови, что обычно происходит после еды. Когда же под действием инсулина глюкоза поступит в клетки и её уровень в крови понизится, секреция инсулина уменьшается. Повышение уровня жирных кислот и аминокислот в крови также стимулирует секрецию инсулина. Кроме того, выделение инсулина увеличивается под влиянием блуждающих нервов, относящихся к парасимпатическому отделу вегетативной нервной системы. В противоположность этому при симпатоадреналовой реакции и при стрессе, когда содержание глюкозы в крови растёт за счёт действия катехоламинов и кортизола, образование инсулина тормозится. В такой ситуации глюкоза не может превращаться в гликоген и потому немедленно используется для покрытия энергетических расходов.
Важно отметить, что нервные клетки, не имеющие собственных запасов глюкозы, получают её непосредственно из крови, причём этот транспорт происходит вне зависимости от инсулина. При выраженной гипогликемии (т.е. при снижении уровня глюкозы в крови ниже критического) развивается гипогликемический шок, при котором человек теряет сознание. С помощью внутривенного введения раствора глюкозы можно обеспечить нервные клетки необходимой для их деятельности энергией и тем самым вывести человека из состояния шока.
Секрецию другого гормона поджелудочной железы, глюкагона стимулирует гипогликемия. Уровень глюкозы в крови понижается через несколько часов после приёма пищи, что приводит к увеличению выделения глюкагона. Он стимулирует расщепление гликогена в печени, а образующаяся глюкоза выходит в кровь, пока там не восстановится её обычное содержание.
Таким образом, два гормона поджелудочной железы – инсулин и глюкагон выступают в качестве антагонистов: первый понижает, а второй повышает до заданного гомеостатического значения колеблющийся в связи с приёмом пищи или голоданием уровень глюкозы в крови. В ответ на увеличение или уменьшение содержания глюкозы в крови эндокринные клетки секретируют нужный для выравнивания гормон.
Третий гормон поджелудочной железы – соматостатин тормозит образование в аденогипофизе гормона роста (следует напомнить, что соматостатин образуется и в гипоталамусе), угнетает секрецию инсулина и глюкагона, а также замедляет всасывание продуктов пищеварения из кишечника в кровь: тем самым он предотвращает чрезмерные колебания уровня глюкозы в крови.
12.10. Половые гормоны
В семенниках мужчины, между семенными канальцами, небольшими скоплениями или поодиночке расположены эндокринные интерстициальные клетки (клетки Лейдига), образующие андрогены: исходным материалом для этого является холестерин, а конечным продуктом – тестостерон, который выделяется в густую сеть кровеносных капилляров, соседствующих с эндокринными клетками. Кроме андрогенов в семенниках мужчины образуется небольшое количество женского полового гормона – эстрадиола.
В одном из яичников женщины детородного возраста каждые 28 дней созревает один фолликул (лат. – пузырёк). Созревший фолликул разрывается, освобождая тем самым готовую к оплодотворению яйцеклетку. До её выхода клетки, образующие оболочку фолликула, синтезируют эстрогены: в кровь поступает эстрадиол. Синтетическими предшественниками эстрогенов являются андрогены, в частности тестостерон, небольшое количество которого и у женщин в норме выделяется в кровь. После выхода яйцеклетки на месте разорвавшегося фолликула образуется т.н. жёлтое тело, которое секретирует ещё один гормон -прогестерон.
Синтезом половых гормонов управляют фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны аденогипофиза. У мужчин ЛГ стимулирует образование тестостерона в клетках Лейдига, в свою очередь высокая концентрация тестостерона в крови уменьшает образование ЛГ в гипофизе и гонадолиберина в гипоталамусе, но мало влияет на синтез ФСГ. В настоящее время предполагают, что ФСГ способствует развитию и созреванию клеток Лейдига, но в основном этот гормон действует на клетки Сертоли в семенниках, которые выполняют опорную и трофическую, т.е. питательную функцию. Они способны связывать и преобразовывать андрогены, поддерживая их необходимую для сперматогенеза концентрацию, а также синтезировать пептидный гормон ингибин, который регулирует секрецию ФСГ гипоталамо-гипофизарной системой (Рис. 12.7).
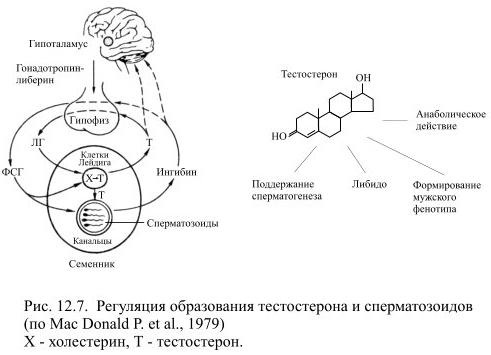
Образование тестостерона у зародыша мужского пола начинается примерно на седьмой неделе внутриутробного развития. Вскоре содержание тестостерона в крови достигает высокого уровня: он стимулирует развитие мужских половых органов – при его отсутствии в генотипически мужском организме (XY) будут формироваться женские половые органы. Под влиянием тестостерона формируются отличия мужского мозга от женского: объём мозга мужчин в среднем на 15% больше, чем у женщин (что почти пропорционально большей массе тела), существуют небольшие анатомические различия в строении гипоталамуса, таламуса и мозолистого тела. При позитронно-эмиссионной томографии у мужчин выявлен более высокий уровень обмена в височных долях мозга, а у женщин – в поясной извилине, облегающей мозолистое тело.
С наступлением пубертатного периода у мальчиков содержание тестостерона в крови начинает расти и достигает характерного для взрослых мужчин уровня примерно в 17 лет, в дальнейшем он остаётся почти неизменным приблизительно до 60 лет, а затем постепенно снижается. Благодаря тестостерону происходит половое созревание, а после него – поддержание нормальной деятельности половых органов и полового поведения. Тестостерон определяет также формирование вторичных половых признаков: развитие костей и мышц по мужскому типу, характер оволосения, строение гортани и высоту голоса и т.п. Особенности строения тела мужчин объясняются анаболическим действием тестостерона (т.е. стимулирующим синтез белка). Все применяемые анаболики являются искусственными аналогами тестостерона. В медицине они назначаются в силу необходимости истощённым и ослабленным больным, а в спорте, где их применяют для увеличения мышечной массы, использование анаболиков преследуется антидопинговыми системами контроля.
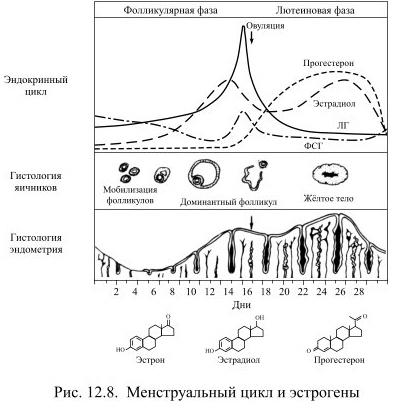
Секреция половых и гонадотропных гормонов в женском организме происходит циклически и определяется 28-дневным сроком развития фолликула. Индивидуальная продолжительность такого цикла определяется временем от начала одного менструального кровотечения до начала следующего, в среднем 28±3 дня. Созревание фолликулов стимулирует ФСГ, но лишь в одном из них развивается зрелая яйцеклетка (примерно в одном из 200 циклов одновременно могут развиться две яйцеклетки их двух фолликулов). Созревающий фолликул выделяет эстрадиол, концентрация которого в крови существенно увеличивается к 8-10 дню после менструации (Рис. 12.8).
Эстрадиол по принципу положительной обратной связи стимулирует секрецию ЛГ в гипофизе (он повышает чувствительность образующих ЛГ клеток гипофиза к гонадолиберину гипоталамуса), а быстро нарастающая концентрация ЛГ вызывает разрыв фолликула и выход яйцеклетки в брюшную полость, а затем в маточную трубу. Выход яйцеклетки обозначается термином овуляция, это событие происходит через 14 дней от начала менструального кровотечения. На месте лопнувшего фолликула образуется жёлтое тело, клетки которого начинают секретировать прогестерон, концентрация которого в крови увеличивается, а содержание гонадотропных гормонов (ФСГ и ЛГ) в это время уменьшается. Продолжается секреция эстрадиола, но в сочетании с прогестероном он уменьшает образование гонадолиберина, ЛГ и ФСГ до наименьшего уровня. Если не происходит оплодотворение яйцеклетки, то жёлтое тело подвергается обратному развитию, содержание прогестерона и эстрадиола в крови уменьшается. Это приводит к сужению сосудов эндометрия (слизистой оболочки матки) и отторжению его внутреннего слоя вместе с кровью – т.е. менструальному кровотечению, начинающему следующий цикл.
Главным событием цикла является овуляция, предшествующая ей половина цикла называется предовуляторной или фолликулиновой, а следующая за овуляцией постовуляторной или лютеиновой фазой (лат. corpus luteum – жёлтое тело). Под влиянием гормона жёлтого тела прогестерона происходит подготовка эндометрия к приёму оплодотворённой яйцеклетки и будущей беременности. Эстрогены также способствуют подготовке матки к беременности, а кроме того – формированию вторичных женских половых признаков (относительно широкие бёдра и узкие плечи, распределение жировой ткани, развитие молочных желёз). Анаболического действия, подобного тестостерону, у эстрогенов нет.
12.11. Стресс
Английский термин stress можно перевести как напряжение, давление, нажим. Этим словом, например, объясняют сопротивление упругой стальной пластины действию внешней силы: сгибая её руками вы ощущаете противодействие, а когда отпустите – она тотчас вернётся к первоначальному состоянию.
Таблица 12.2
Классификация стрессоров (по W. Janke, 1974)
1. Внешние стрессоры
а) сильный шум, свет, вибрация;
б) лишение или ограничение сенсорной информации (сенсорная депри- вация);
в) болевые стимулы (механические, термические, электрические или хи- мические);
г) ситуация реальной опасности или принимаемая за таковую.
2. Невозможность удовлетворить физиологические потребности в:
а) пище;
б) воде;
в) сне;
г) комфортной температуре;
в) движении (вынужденное прекращение движений).
3. Стрессоры, связанные с характером деятельности:
а) чересчур интенсивная деятельность (работа или развлечения);
б) монотонная, однообразная деятельность;
в) вынужденное прекращение деятельности, критика выполняемой рабо- ты, экзамены.
4. Социальные стрессоры:
а) изоляция от общества;
б) межличностные конфликты;
в) изменения обычного образа жизни;
г) утрата близкого человека;
д) разлучение с родителями.
5. Конфликт (необходимость альтернативного выбора), неопределённость в связи с ожидаемыми событиями.
Благодаря выдающемуся канадскому учёному Гансу Селье (Selye H.) в словари вошло новое значение термина стресс: совокупность всех неспецифических изменений, возникающих под влиянием любых сильных воздействий и сопровождающихся перестройкой защитных систем организма. Первая статья Селье,
посвящённая этой проблеме, появилась ещё в 1936 году в журнале "Nature"; она называлась: "Синдром, вызываемый различными повреждающими агентами". О том, насколько часто развивается стресс, можно судить хотя бы по перечню наиболее характерных стрессоров, т.е. факторов, вызывающих эту реакцию (Табл. 12.2).
Классическими признаками стресса являются увеличение коры надпочечников, уменьшение вилочковой железы, а также массы лимфатической ткани и острые изъязвления слизистой желудка; одновременно с этим повышается сопротивление организма к действующему на него стрессору. Развитие всех этих проявлений Селье поначалу связывал с активацией передней доли гипофиза (увеличение секреции АКТГ) и коры надпочечников (повышение продукции кортизола). Затем было установлено, что непосредственным стимулом для повышения образования АКТГ в аденогипофизе является вырабатываемый в гипоталамусе кортикотропин-либерин.
Селье выделил три стадии в развитии стресса: тревога, резистентность (сопротивление) и истощение (Рис.12.9).
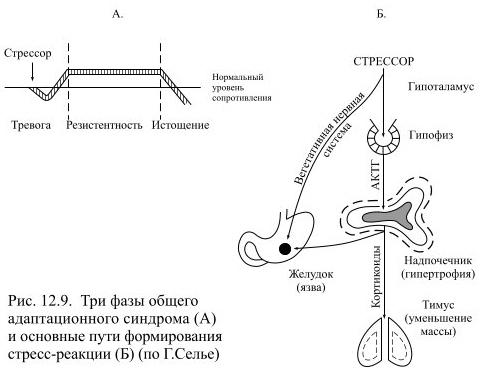
В стадии тревоги сопротивление организма стрессору падает ниже нормы, в стадии резистентности оно поднимается значительно выше обычного. В этой стадии масса коры надпочечников увеличивается, уровень кортизола в крови повышается и происходит мобилизация адаптационных резервов. Если стрессор продолжает действовать долго и адаптационные резервы будут исчерпаны, то наступит стадия истощения и гибель.
В последнее время принято различать срочную и долговременную формы адаптации. На действие стрессора организм сначала отвечает мгновенной симпатоадреналовой реакцией, мобилизующей большое количество энергии (См. 12.6, а также рис. 12.4). Если действие стрессора не прекращается, организму приходится приспосабливаться к нему, переходить на другой уровень функционирования, позволяющий сохранить гомеостаз в изменившихся условиях. Любой стрессор изменяет активность нейронов гипоталамуса: это происходит либо под влиянием афферентной импульсации от рецепторов, на которые он действует, либо ещё и при посредничестве коры и лимбической системы мозга, что особенно характерно для социальных стрессоров. В большинстве случаев при стрессе повышается уровень активности ретикулярной формации ствола мозга.
Увеличение образования кортикотропин-либерина и АКТГ при стрессе происходит достаточно быстро, оно было обнаружено уже через две минуты после действия стрессора. Этому способствует не только афферентный приток нервных импульсов к гипоталамусу, но и гуморальное действие катехоламинов, поступивших в кровь из мозгового вещества надпочечников при симпатоадреналовой реакции. Под влиянием АКТГ быстро повышается образование кортизола в коре надпочечников и его выход в кровь.
Кортизол поддерживает повышенный уровень сахара и аминокислот в крови, что в условиях стресса чрезвычайно важно для деятельности мозга, сердца и тех органов, на которые, в зависимости от природы стрессора, выпадает особенно большая нагрузка. Для того, чтобы эти органы бесперебойно обеспечивались энергией, кортизол стимулирует расщепление углеводов и жиров в других тканях, как бы облагая их дополнительным налогом на время стресса. Такую дань платят мало работающие скелетные мышцы, соединительная и лимфоидная ткань, в которых под влиянием кортизола начинают разрушаться даже белки, а освобождающиеся в связи с этим аминокислоты используются в органах, вынужденных работать особенно интенсивно. Так, например, в сердце образуются дополнительные митохондрии, поставляющие энергию для усиленной работы сократительных белков.
Можно сказать, что кортизол обеспечивает стратегическую переброску энергетических и строительных ресурсов одним органам за счёт других, которые, разумеется, вынуждены терпеть лишения. Происходит похудание, уменьшается вилочковая железа, селезёнка, снижается количество лимфоцитов в крови, что весьма характерно для стресса. Поскольку разные виды лимфоцитов осуществляют иммунные реакции, уменьшение их количества приводит к понижению иммунной защиты и ослабленному сопротивлению инфекциям. В то же время в очагах воспаления кортизол уменьшает воспалительные реакции: он укрепляет лизосомы клеток и этим препятствует выходу из них ферментов, расщепляющих белки и повышающих проницаемость сосудов – в результате стихает боль и уменьшается краснота и отёчность.
При высокоразвитой нервной системе человека самыми частыми стрессорами стали эмоциональные раздражители, которые могут способствовать возникновению т.н. психосоматических заболеваний. В качестве примера таких заболеваний чаще всего приводят язву желудка или двенадцатиперстной кишки. Известны эксперименты, в которых у крысы вызывали стресс лишением возможности двигаться, для чего запирали её на пару часов в узкой трубе: во многих случаях это приводило к образованию язв желудка. Симпатическая активация при стрессе приводит к уменьшению кровообращения в сосудах желудка, а вследствие этого уменьшается образование защитной слизи. При таких условиях содержащаяся в желудочном соке соляная кислота повреждает слизистую желудка и кровеносные сосуды. Обычно вслед за симпатической активацией компенсаторно повышается активность блуждающих нервов, которые стимулируют выделение соляной кислоты. Такой же эффект, т.е. уменьшение кровоснабжения слизистой желудка и повышенное выделение соляной кислоты можно обнаружить и при электрической стимуляции некоторых ядер миндалин мозга, а миндалины играют исключительно важную роль в формировании психоэмоционального стресса
К развитию стресса приводят не только неприятные события. В качестве доказательства этого утверждения Селье приводил следующий пример: мать, получившая известие о гибели сына, переживает сильнейший стресс. Но, если через какое-то время окажется, что сообщение было ложным и сын неожиданно вернётся к матери, то она снова перенесёт стресс. В этот же ряд можно поставить сообщение о смерти в 1997 году пожилой жительницы Еревана, испытавшей чрезвычайное потрясение от того, что после многомесячного отсутствия электроэнергии в её доме снова появился свет.
Таким образом, важны не столько приятные или неприятные ощущения, связанные со стрессором, сколько интенсивность требований к приспособительным возможностям организма. Селье предложил называть неприятный стресс термином дистресс в отличие от физиологического стресса, который можно обнаружить в нормальной деятельности человека, например, у спортивного болельщика, переживающего за любимую команду, у влюблённого, предвкушающего страстный поцелуй, или у хозяйки, ожидающей реакции гостей на её кулинарные изыски. Лишь когда мы становимся равнодушными ко всему, уровень стресса снижается, но и в этом случае он не равен нулю: полная свобода от стресса означает смерть.
Резюме
Любые изменения условий жизни заставляют переходить на новый уровень функционирования. Этот переход регулируют не только быстрые и точные нервные механизмы, но и процессы эндокринной регуляции функций. Они протекают медленнее, зато могут осуществлять регуляцию в течение длительного времени и обеспечивать адаптивную перестройку обменных процессов во многих клетках, в том числе и в тех, что не находятся под прямым контролем нервной системы. Нервные и эндокринные механизмы регуляции гомеостаза хорошо согласованы благодаря единому центру координации этой деятельности в гипоталамусе. Периферические железы внутренней секреции не находятся под прямым контролем нервной системы, однако испытывают её влияние в связи с изменениями кровоснабжения и в связи с изменениями уровня гормонов других желёз, в первую очередь, гипофиза. В связи с этим можно говорить о единой нейроэндокринной регуляции функций.
Вопросы для самоконтроля
185. Какой из указанных гормонов является производным аминокислоты?
А. Инсулин; Б. Соматотропин; В. Кортизол; Г. Адреналин; Д. Вазопрессин.
186. Какой из перечисленных ниже гормонов способен проходить через клеточную мембрану?
А. Кортикотропин; Б. 3-Йодтиронин; В. Глюкагон; Г. Окситоцин; Д. Тиреотропин.
187. Какой из указанных гормонов не образуется в аденогипофизе?
А. Соматотропин; Б. Лютеотропин; В. Пролактин; Г. Тироксин; Д. Кортикотропин.
188. Какой из перечисленных ниже гормонов стимулирует синтез белка?
А. Соматотропин; Б. Адреналин; В. Кортикотропин; Г. Вазопрессин; Д. Эстрадиол.
189. Какой гомеостатический сдвиг приводит к повышенному образованию вазопрессина?
А. Повышение уровня глюкозы в крови; Б. Повышение осмотического давления; В. Понижение артериального давления; Г. Понижение парциального давления углекислого газа; Д. Повышение парциального давления кислорода.
190. Что произойдёт после повышения секреции вазопрессина?
А. Увеличение реабсорбции воды а почечных канальцах; Б. Увеличение осмотического давления крови; В. Увеличение концентрации натрия в крови; Г. Увеличение диуреза; Д. Уменьшение объёма жидкости в кровяном русле.
191. Что произойдёт вследствие повышенной секреции адреналина?
А. Ускоренное образование гликогена; Б. Ускоренное образование жиров; В. Ускоренный синтез белка; Г. Увеличенное образование глюкозы; Д. Уменьшение минутного объёма кровотока.
192. Какой из указанных ниже гормонов препятствует развитию воспалительных реакций?
А. Кортикотропин; Б. Альдостерон; В. Кортизол; Г. Дегидроэпиандростерон; Д. Адреналин.
193. Какой гормон задерживает выведение натрия из организма?
А. Вазопрессин; Б. Окситоцин; В. АКТГ; Г. Альдостерон; Д. Тироксин.
194. Какой гормон стимулирует выведение калия из организма?
А. Ренин; Б. Альдостерон; В. Кортизол; Г. Вазопрессин; Д. Окситоцин.
195. Действие какого вещества является самым мощным стимулом для образования альдостерона в коре надпочечников?
А. Ренин; Б. Ангиотензиноген; В. Ангиотензин I; Г. Ангиотезин II; Д. АКТГ.
196. Какой из перечисленных гормонов существенно повышает скорость энергетических процессов в клетках?
А. АКТГ; Б. Кортизол; В. Альдостерон; Г. Пролактин; Д. Тироксин.
197. Какой из указанных ниже гормонов может понижать содержание глюкозы в крови?
А. Адреналин; Б. Инсулин; В. Кортизол; Г. Соматотропин; Д. Глюкагон.
198. К повышенному выделению какого гормона приводит гипогликемия?
А. Глюкагон; Б. Адреналин; В. Кортизол; Г. Инсулин; Д. Вазопрессин.
199. Какой гормон способствует превращению глюкозы в гликоген в печени?
А. Глюкагон; Б. Адреналин; В. Инсулин; Г. Кортизол; Д. Соматотропин.
200. Образование какого гормона должно уменьшаться вследствие повышения содержания тестостерона в крови?
А. ФСГ; Б. ЛГ; В. Эстрон; Г. Эстрадиол; Д. Прогестерон.
201. Какой гормон определяет формирование половых различий мозга человека?
А. Прогестерон; Б. Тестостерон; В. Эстрадиол; Г. Фоллитропин; Д. Лютеотропин.
202. Какой из указанных ниже гормонов начинает синтезироваться в постовуляторной фазе менструального цикла?
А. Эстрон; Б. Эстрадиол; В. Прогестерон; Г. Фолликулостимулирующий гормон; Д. Лютеинизирующий гормон.
203. Что из указанного ниже не является характерным признаком стресс-реакции?
А. Повышенная секреция кортикотропина; Б. Повышенная секреция кортизола; В. Увеличение коры надпочечников; Г. Увеличение массы лимфоидной ткани; Д. Появление небольших язв на слизистой желудка.
204. С действием какого гормона связаны физиологические проявления симпатоадреналовой реакции?
А. Кортикотропин-либерин; Б. Кортикотропин; В. Кортизол; Г. Адреналин: Д. Альдостерон.
| Назад | Оглавление | Далее |