Медицинская реабилитация
6. Нейромедиаторы
6.1. Происхождение и химическая природа нейромедиаторов
Выделение нейромедиаторов пресинаптическими окончаниями нейронов напоминает секрецию эндокринных желёз, выделяющих в кровь свои гормоны. Но гормоны обычно действуют на клетки, находящиеся на удалении от самой железы, тогда как мишенями для нейротрансмиттеров являются лишь постсинаптические нейроны. Поэтому у любого медиатора очень короткий путь до цели, а его действие оказывается быстрым и точным. Точности способствует наличие активных зон – специализированных областей пресинаптической мембраны, где обычно происходит выделение нейротрансмиттера. Если же медиатор выделяется через неспецифические участки мембраны, то точность его действия уменьшается, а само действие замедляется. Такая картина наблюдается, например, в синапсах, образованных между нейронами вегетативной нервной системы и гладкими мышцами.
Но иногда действие медиатора не ограничено только соседней клеткой, и в таких случаях он действует как модулятор с достаточно широким спектром деятельности. А отдельные нейроны выделяют свой продукт в кровь, и тогда он действует уже как нейрогормон. Несмотря на то, что по своей химической природе многие нейромедиаторы существенно отличаются, результат их влияния на постсинаптическую клетку (т.е. возбуждение или торможение) определяется не химической структурой, а типом ионных каналов, которыми медиатор управляет с помощью постсинаптических рецепторов.
Существует несколько критериев, по которым то или иное вещество можно определить как нейромедиатор:
1. Синтез этого вещества происходит в нервных клетках.
2. Синтезированные вещества накапливаются в пресинаптических окончаниях, а после выделения оттуда оказывают специфическое действие на постсинаптический нейрон или эффектор.
3. При искусственном введении этого вещества обнаруживается такой же эффект, как и после выделении его естественным способом.
4. Существует специфический механизм удаления медиатора с места его действия.
Некоторые исследователи считают, что ток кальция в пресинаптическое окончание, приводящий к выделению медиатора, тоже следует рассматривать в качестве одного из критериев, по которым определяют принадлежность вещества к нейромедиаторам. И ещё одним доказательством можно считать возможность блокировать эффект предполагаемого медиатора специально подобранными фармакологическими веществами. Далеко не всегда удаётся экспериментально подтвердить существование сразу всех этих критериев.
В зависимости от химической структуры различают низкомолекулярные и пептидные нейротрансмиттеры (Рис. 6.1).

К низкомолекулярным медиаторам относятся ацетилхолин, биогенные амины, гистамин, аминокислоты и их производные. В списке медиаторов белковой природы значится свыше 50 коротких пептидов. Нейроны, выделяющие определённый медиатор, а также синапсы, в которых он используется и постсинаптические рецепторы для него принято называть …-эргическими, где вместо многоточия ставится название конкретного медиатора: например, ГАМК-эргические нейроны, адренэргические синапсы, холинорецепторы, пептидэргические структуры и т.п.
Вещества, оказывающие на постсинаптические рецепторы такое же действие, как и сам медиатор, называют агонистами, а вещества, связывающиеся с постсинаптическими рецепторами и блокирующие их без присущего медиатору действия, – антагонистами. Эти термины обычно применяются для характеристики каких-либо фармакологических веществ: так, например, введение агонистов приводит к обычной для медиатора или даже усиленной деятельности синапса, а введение антагониста блокирует синапс так, что медиатор не может вызвать привычный для него эффект.
6.2. Синтез нейромедиаторов
Для каждого нейротрансмиттера существуют свои механизмы синтеза. Ацетилхолин, например, образуется с помощью фермента ацетилтрансферазы из ацетилкоэнзима А, встречающегося только в нервных клетках, и холина, захваченного нейроном из крови. Биогенные амины синтезируются из аминокислоты тирозина в следующем порядке: тирозин Þ L-ДОФА (диоксифенилаланин) Þ дофамин Þ норадреналин Þ адреналин, причём каждое преобразование обеспечивается специфическим ферментом. Серотонин получается при ферментативном окислении и декарбоксилировании аминокислоты триптофана.
ГАМК появляется при декарбоксилировании глутаминовой кислоты, а глицин и глутамат представляют собой две из двадцати имеющихся в организме аминокислот, однако, несмотря на их существование почти во всех клетках, в качестве медиаторов эти аминокислоты используются отнюдь не всеми нейронами. Следует различать встречающиеся в самых разных клетках чисто метаболические глицин или глутамат от сберегаемых в синаптических пузырьках – лишь в последнем случае аминокислоты применяются в качестве медиаторов.
Ферменты для синтеза низкомолекулярных нейротрансмиттеров находятся, как правило, в цитоплазме, а синтез происходит на свободных полисомах. Образовавшиеся молекулы медиатора упаковываются в синаптические пузырьки и медленным аксоплазматическим транспортом доставляются в окончание аксона. Но и в самом окончании может происходить синтез низкомолекулярных медиаторов.
Пептидные нейротрансмиттеры образуются только в клеточном теле из молекул белка-предшественника. Их синтез происходит в эндоплазматическом ретикулуме, дальнейшие преобразования – в аппарате Гольджи. Оттуда молекулы медиатора в секреторных пузырьках попадают в нервное окончание с помощью быстрого аксонального транспорта. В синтезе пептидных медиаторов участвуют ферменты – серинпротеазы. Пептиды могут выполнять роль как возбуждающих, так и тормозных медиаторов. Некоторые из них, как, например, гастрин, секретин, ангиотензин, вазопрессин и т.п. раньше были известны как гормоны, действующие вне мозга (в желудочно-кишечном тракте, почках). Однако, если они действуют непосредственно в месте своего выделения, их тоже рассматривают в качестве нейротрансмиттеров.
6.3. Выделение медиаторов
Для того, чтобы молекулы медиатора попали в синаптическую щель, синаптический пузырёк должен сначала слиться с пресинаптической мембраной в её активной зоне. После этого в пресинаптической мембране образуется увеличивающееся примерно до 50 нм в диаметре отверстие, через которое всё содержимое пузырька опорожняется в щель (Рис. 6.2). Этот процесс называется экзоцитозом. Когда необходимости в выделении медиатора нет, большая часть синаптических пузырьков бывает прикреплена к цитоскелету специальным белком (он называется синапсин), который по своим свойствам напоминает сократительный мышечный белок актин.
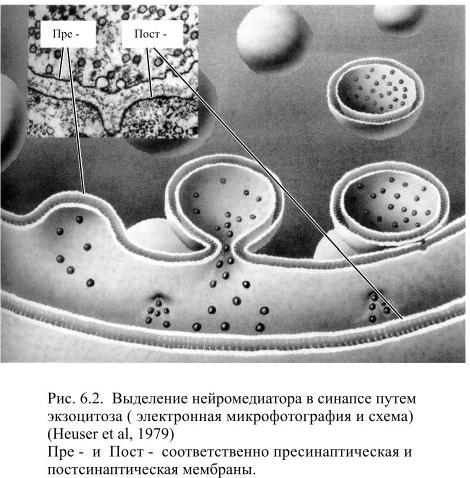
Когда нейрон возбуждается и потенциал действия достигает пресинаптического окончания, в нём открываются потенциалзависимые каналы для ионов кальция. Их плотность особенно высока в области активных зон – около 1500/ мкм2. В большинстве нейронов ток ионов кальция в нервное окончание наблюдается и при мембранном потенциале покоя, что обусловлено электрохимическим градиентом. Но во время деполяризации мембраны ток кальция увеличивается, а на вершине пика потенциала действия он становится максимальным и приблизительно через 0,2 мс после этого происходит выделение медиатора.
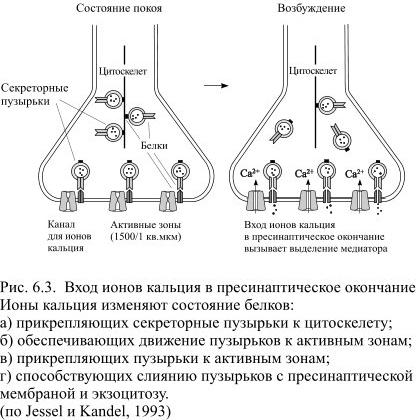
Роль ионов кальция состоит в том, чтобы преобразовать вызванную возбуждением нейрона деполяризацию в неэлектрическую активность – выделение медиатора. Без входящего тока ионов кальция нейрон фактически лишается своей выходной активности. Кальций нужен для взаимодействия белков мембраны синаптических пузырьков – синаптотагмина и синаптобревина с белками плазматической мембраны аксона – синтаксином и неурексином. В результате взаимодействия этих белков синаптические пузырьки перемещаются к активным зонам и прикрепляются к плазматической мембране. Только после этого начинается экзоцитоз (Рис. 6.3).
Некоторые нейротоксины, например ботулинический, повреждают синаптобревин, что препятствует выделению медиатора – о тяжелых последствиях ботулизма уже говорилось в предыдущей главе. Ещё один нейротоксин – яд пауков рода Latrodectus связывает другой белок -неурексин, что приводит к быстрому опустошению пузырьков с медиатором. После укуса каракурта, одного из представителей этого рода пауков, у человека немеют ноги, его мучает удушье, мышцы живота становятся твёрдыми, как доска, возникает нестерпимая боль в животе и груди, наступает сильное психическое возбуждение, страх смерти, а иногда и сама смерть. Американский родственник каракурта – чёрная вдова (black widow) пользуется тем же ядом, что и каракурт, уступая, впрочем, каракурту в убойной силе.
Небольшое количество медиатора выделяется и без возбуждения нейрона, происходит это малыми порциями – квантами, что было впервые обнаружено в нервно-мышечном синапсе. В результате выделения одного кванта на мембране концевой пластинки возникает миниатюрный подпороговый потенциал величиной около 0,5 – 1 мВ. Выяснено, что для такой деполяризации концевой пластинки в ней надо открыть минимум 2000 каналов, а чтобы открыть столько каналов, необходимо приблизительно 5000 молекул ацетилхолина, следовательно квант представляет собой порцию медиатора, содержащуюся всего лишь в одном синаптическом пузырьке. Для возникновения нормального потенциала концевой пластинки требуется освободить около 150 квантов медиатора, но за очень короткое время – не более 2 мс.
В большинстве синапсов центральной нервной системы после вхождения ионов кальция в пресинаптическое окончание выделяется от 1 до 10 квантов медиатора, поэтому одиночные потенциалы действия практически всегда оказываются подпороговыми. Количество выделяемого медиатора увеличивается, когда к пресинаптическому окончанию поступает серия высокочастотных потенциалов действия. В этом случае растёт и амплитуда постсинаптического потенциала, т.е. происходит временная суммация.
После высокочастотной стимуляции пресинаптического окончания наблюдается повышение эффективности синаптической передачи в течение нескольких минут, а у отдельных нейронов ещё дольше – до часа, когда в ответ на одиночный потенциал действия медитора выделяется больше, чем обычно. Это явление получило название посттетанической потенциации. Объясняется оно тем, что при высокочастотной или тетанической стимуляции растёт концентрация свободного кальция в нервном окончании и им насыщаются буферные системы, прежде всего эндоплазматический ретикулум и митохондрии. В связи с этим активируется специализированный фермент: кальций-кальмодулин-зависимая протеинкиназа. Этот фермент вызывает повышенное отхождение синаптических пузырьков от цитоскелета. Освободившиеся синаптические пузырьки направляются к пресинаптической мембране и сливаются с ней, после этого происходит экзоцитоз.
Повышение эффективности синаптической передачи является одним из механизмов образования памяти, а накопление ионов кальция в пресинаптическом окончании можно рассматривать как один из способов хранения информации о предшествующей высокой активности нейрона.
6.4. Разные постсинаптические рецепторы: ионотропное и метаботропное управление
Представление о рецепторах сформулировал ещё в конце XIX века знаменитый германский учёный Пауль Эрлих (Erlich P.): " Химические субстанции влияют только на те элементы ткани, с которыми они могут связаться. Эта связь должна быть специфичной, т.е. химические группы должны соответствовать друг другу, как ключ и замок". Постсинаптические рецепторы представляют собой трансмембранные белки, у которых наружная часть узнаёт и связывает молекулы медиатора. Вместе с тем, их можно рассматривать ещё и как эффекторы, управляющие открытием и закрытием хемозависимых ионных каналов. Есть два принципиально отличающихся способа управления каналами: ионотропный и метаботропный.
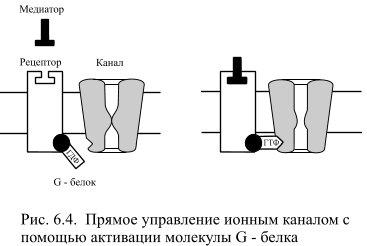
При ионотропном управлении рецептор и канал представляют собой единую макромолекулу. Если к рецептору присоединяется медиатор, то конформация всей молекулы изменяется так, что в центре канала образуется пора и через неё проходят ионы. При метаботропном управлении рецепторы не связаны с каналом напрямую и поэтому присоединение медиатора и открытие канала разделены несколькими промежуточными этапами, в которых участвуют вторичные посредники. Первичным посредником является сам медиатор, который при метаботропном управлении присоединяется к рецептору, действующему на несколько молекул G-белка, который представляет собой длинную извитую аминокислотную цепь, пронизывающие клеточную мембрану семью своими петлями. Известно около дюжины разновидностей G-белков, все они связаны с нуклеотидом гуанозинтрифосфатом (ГТФ). Присоединение нейротрансмиттера к рецептору вызывает сразу в нескольких связанных с ним молекулах G-белка, превращение бедного энергией предшественника – гуанозиндифосфата (ГДФ) в ГТФ.
Такого рода преобразования, обусловленные присоединением остатка фосфорной кислоты, называются фосфорилированием. Вновь образующаяся связь богата энергией, поэтому молекулы G-белка, в которых произошло превращение ГДФ в ГТФ, становятся активированными (Рис. 6.4). Активация белковых молекул может проявляться в изменении их конформации, а у ферментов она обнаруживается в повышении сродства к субстрату, на который действует фермент.
Приобретённая активность у G-белков направлена на стимуляцию или подавление активности (в зависимости от типа G-белка) некоторых ферментов (аденилатциклазы, гуанилатциклазы, фосфолипаз А 2 и С), которые в случае активации вызывают образование вторичных посредников. Конкретный ход дальнейших событий зависит от типа преобразующего сигнал белка. В случае прямого управления ионными каналами активированная молекула G-белка перемещается по внутренней поверхности мембраны к ближайшему ионному каналу и присоединяется к нему, что приводит к открытию этого канала. При непрямом управлении активированный G-белок использует одну из систем вторичных посредников, которые либо управляют ионными каналами, либо изменяют характер метаболизма – обменных процессов в клетке, либо вызывают экспрессию определённых генов, за которой следует синтез новых белков, что, в конечном счёте, тоже приводит к изменению характера обменных процессов. Из вторичных посредников лучше всего изучен циклический аденозинмонофосфат (цАМФ), образование которого осуществляется в несколько этапов (Рис. 6.5).
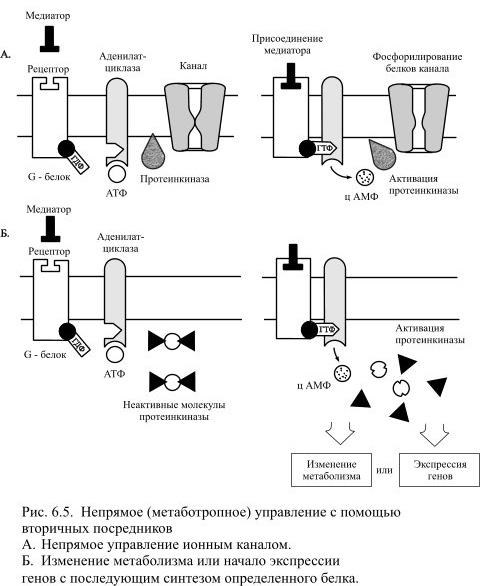
Активированный G-белок действует на интегральный белок клеточной мембраны – аденилатциклазу, которая является ферментом. Активированная аденилатциклаза вызывает превращение молекул аденозинтрифосфата (АТФ) в циклический аденозинмонофосфат (цАМФ), причём одна молекула аденилатциклазы вызывает образование множества молекул цАМФ. Молекулы цАМФ могут свободно диффундировать в цитоплазме, становясь, таким образом, переносчиками полученного сигнала внутри клетки. Там они находят ферменты – цАМФ-зависимые протеинкиназы и активирует их. Протеинкиназы стимулируют определённые биохимические реакции – характер обменных процессов направленно изменяется.
Следует обратить внимание на усиление слабого синаптического сигнала при такой последовательности событий. Присоединение одной молекулы нейротрансмиттера к рецептору сопровождается активацией нескольких молекул G-белков. Каждая молекула G-белка может активировать несколько молекул аденилатциклазы. Каждая молекула аденилатциклазы вызывает образование множества молекул цАМФ. По такому же принципу, но с участием других типов G-белка активируются другие системы известных вторичных посредников (Рис. 6.6).
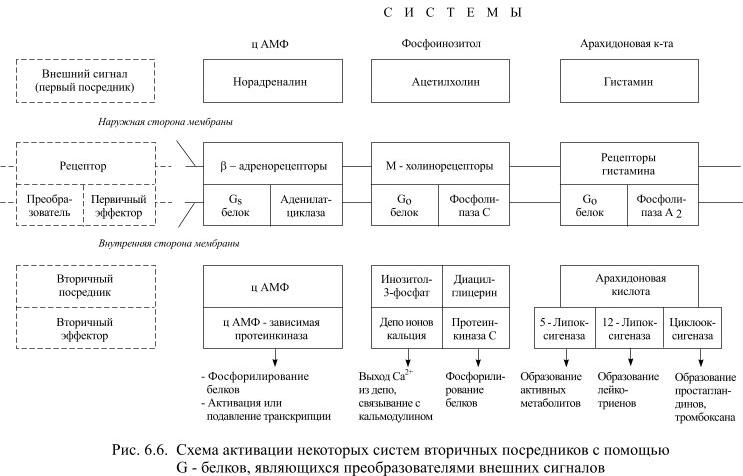
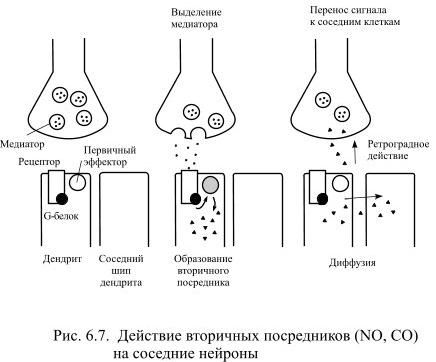
Некоторые вторичные посредники могут диффундировать через мембрану клетки и оказывать действие на соседние нейроны, в том числе и на пресинаптический (Рис. 6.7).
Таким, образом, ионотропное управление является непосредственным: лишь только медиатор присоединится к рецептору – открывается ионный канал, причём всё происходит очень быстро, в течение тысячных долей секунды. При метаботропном управлении ответ на присоединение медиатора непрямой, он требует участия преобразующих белков и включает активацию вторичных посредников, а поэтому и появляется значительно позже, чем ионотропный: спустя секунды, а иногда и минуты. Зато при метаботропном управлении обусловленные действием медиатора изменения сохраняются дольше, чем при ионотропном управлении. Ионотропным управлением чаще пользуются низкомолекулярные медиаторы, а нейропептиды чаще активируют системы вторичных посредников, однако эти различия не абсолютны. К ионотропным рецепторам относятся Н-холинорецепторы, один тип рецепторов для ГАМК, два типа рецепторов для глутамата, рецепторы глицина и серотонина. К метаботропным принадлежат рецепторы нейропептидов, М-холинорецепторы, альфа- и бета-адренорецепторы, по одному типу рецепторов для ГАМК, глутамата и серотонина, а также обонятельные рецепторы.
Ещё один вид рецепторов находится не на постсинаптической, а на пресинаптической мембране – это ауторецепторы. Они связаны с G-белком пресинаптической мембраны, их функция состоит в регуляции количества молекул медиатора в синаптической щели. Одни ауторецепторы связываются с медиатором, если его концентрация становится чрезмерной, другие – если недостаточной. После этого меняется интенсивность выделения медиатора из пресинаптического окончания: уменьшается в первом случае и увеличивается – во втором. Ауторецепторы являются важным звеном обратной связи, с помощью которой регулируется стабильность синаптической передачи.
6.5. Удаление медиаторов из синаптической щели
К судьбе выполнившего свою роль в передаче сигнала медиатора применима поговорка: мавр сделал своё дело – мавр должен уйти. Если медиатор останется на постсинаптической мембране, то он помешает передаче новых сигналов. Существует несколько механизмов для устранения использованных молекул медиатора: диффузия, ферментативное расщепление и повторное использование.
Путём диффузии из синаптической щели всегда уходит какая-то часть молекул медиатора, а в некоторых синапсах этот механизм является основным. Ферментативное расщепление представляет собой главный способ удаления ацетилхолина в нервно-мышечном синапсе: этим занимается холинэстераза, прикреплённая по краям складок концевой пластинки. Образующиеся при этом ацетат и холин специальным механизмом захвата возвращаются в пресинаптическое окончание.
Известны два фермента, расщепляющие биогенные амины: моноаминооксидаза (МАО) и катехол-о-метилтрансфераза (КОМТ). Расщепление нейротрансмиттеров белковой природы может происходить под действием внеклеточных пептидаз, хотя обычно такие медиаторы исчезают из синапса медленнее, чем низкомолекулярные, и нередко покидают синапс путём диффузии.
Повторное использование медиаторов основано на специфических для разных нейротрансмиттеров механизмах захвата их молекул как самими нейронами, так и клетками глии, в этом процессе участвуют особые транспортные молекулы. Специфические механизмы повторного использования известны для норадреналина, дофамина, серотонина, глутамата, ГАМК, глицина и холина (но не ацетилхолина). Некоторые психофармакологические вещества блокируют повторное использование медиатора (например, биогенных аминов или ГАМК) и, тем самым, продлевают их действие.
6.6. Отдельные медиаторные системы
Химическая структура важнейших нейромедиаторов представлена на рисунке 6.1.
6.6.1. Ацетилхолин
Образуется с помощью фермента ацетилтрансферазы из ацетилкоэнзима А и холина, который нейроны не синтезируют, а захватывают из синаптической щели или из крови. Это единственный медиатор всех мотонейронов спинного мозга и вегетативных ганглиев, в этих синапсах его действие опосредовано Н-холинорецепторами, а управление каналами прямое, ионотропное. Ацетилхолин выделяется также постганглионарными окончаниями парасимпатического отдела вегетативной нервной системы: здесь он связывается с М-холинорецепторами, т.е. действует метаботропно. В головном мозгу его используют в качестве нейротрансмиттера многочисленные пирамидные клетки коры, действующие на базальные ганглии, например, в хвостатом ядре выделяется примерно 40% от общего количества образующегося в мозгу ацетилхолина. С помощью ацетилхолина миндалины мозга возбуждают клетки коры больших полушарий.
М-холинорецепторы обнаружены во всех отделах мозга (кора, структуры лимбической системы, таламус, ствол), их особенно много в ретикулярной формации. С помощью холинэргических волокон средний мозг связан с другими нейронами верхних отделов ствола, зрительными буграми и корой. Возможно активация именно этих путей обязательна для перехода от сна к бодрствованию, во всяком случае характерные изменения электроэнцефалограммы после приёма ингибиторов холинэстеразы подтверждают такую версию.
При прогрессирующем слабоумии, известном как болезнь Альцгеймера, выявлено снижение активности ацетилтрансферазы в нейронах ядер Мейнерта, расположенных в базальном отделе переднего мозга, непосредственно под полосатым телом. В связи с этим нарушается холинэргическая передача, что рассматривается как важное звено в развитии болезни.
Антагонисты ацетилхолина, как показано в экспериментах на животных, затрудняют образование условных рефлексов и снижают эффективность умственной деятельности. Ингибиторы холинэстеразы приводят к накоплению ацетилхолина, что сопровождается улучшением кратковременной памяти, ускоренным образованием условных рефлексов и лучшим сохранением следов памяти.
Достаточно популярно представление о том, что холинэргические системы мозга крайне необходимы для осуществления его интеллектуальной деятельности и для обеспечения информационного компонента эмоций.
6.6.2. Биогенные амины
Как уже говорилось, биогенные амины синтезируются из тирозина, причём каждый этап синтеза контролирует специальный фермент. Если в клетке есть полный набор таких ферментов, то она будет выделять адреналин и в меньшем количестве его предшественники – норадреналин и дофамин. Например, т.н. хромаффинные клетки мозгового вещества надпочечников выделяют адреналин (80% секреции), норадреналин (18%) и дофамин (2%). Если нет фермента для образования адреналина, то клетка может выделять только норадреналин и дофамин, а если нет и фермента, требующегося для синтеза норадреналина, то единственным выделяемым медиатором будет дофамин, предшественник которого – L-ДОФА в качестве медиатора не используется.
Дофамин, норадреналин и адреналин часто объединяют термином катехоламины. Они управляют метаботропными адренорецепторами, которые есть не только в нервной, но и в других тканях организма. Адренорецепторы подразделяются на альфа -1 и альфа-2, бета-1 и бета-2: физиологические эффекты, вызванные присоединением катехоламинов к разным рецепторам, существенно отличаются. Соотношение разных рецепторов неодинаково у разных клеток-эффекторов. Наряду с адренорецепторами, общими для всех катехоламинов, существуют специфические рецепторы для дофамина, которые обнаружены в центральной нервной системе и в других тканях, например, в гладких мышцах кровеносных сосудов и в сердечной мышце.
Адреналин является главным гормоном мозгового вещества надпочечников, к нему особенно чувствительны бета-рецепторы. Есть сведения и об использовании адреналина некоторыми клетками мозга в качестве медиатора. Норадреналин выделяют постганглионарные нейроны симпатического отдела вегетативной нервной системы, а в центральной нервной системе – отдельные нейроны спинного мозга, мозжечка и коры больших полушарий. Самое большое скопление норадренэргических нейронов представляют собой голубые пятна – ядра мозгового ствола.
Считается, что с активностью этих норадренэргических нейронов связано наступление фазы парадоксального сна, однако только этим их функция не ограничивается. Ростральнее голубых пятен также есть норадренэргические нейроны, чрезмерная активность которых играет ведущую роль в развитии т.н. синдрома паники, сопровождающегося чувством непреодолимого ужаса.
Дофамин синтезируют нейроны среднего мозга и диэнцефальной области, которые образуют три дофаминэргические системы мозга. Это, во-первых, нигростриатная система: она представлена нейронами чёрной субстанции среднего мозга, аксоны которых заканчиваются в хвостатых ядрах и скорлупе. Во-вторых, это мезолимбическая система, сформированная нейронами вентральной покрышки моста, их аксоны иннервируют перегородку, миндалины, часть лобной коры, т.е. структуры лимбической системы мозга. И, в третьих, мезокортикальная система: её нейроны в среднем мозгу, а их аксоны оканчиваются в передней части поясной извилины, глубоких слоях фронтальной коры, энторинальной и пириформной (грушевидной) коре. Наивысшая концентрация дофамина обнаружена в лобной коре.
Дофаминэргические структуры играют видную роль в формировании мотиваций и эмоций, в механизмах удержания внимания и отборе наиболее значимых сигналов, поступающих в центральную нервную систему с периферии. Дегенерация нейронов чёрной субстанции приводит к комплексу двигательных расстройств, который известен как болезнь Паркинсона. Для лечения этой болезни используют предшественник дофамина – L-ДОФА, способный, в отличие от самого дофамина, преодолевать гематоэнцефалический барьер. В некоторых случаях предпринимаются попытки лечить болезнь Паркинсона введением ткани мозгового вещества надпочечников плода в желудочек мозга. Введённые клетки могут сохраняться до года и при этом вырабатывать значительное количество дофамина.
При шизофрении обнаруживается повышенная активность мезолимбической и мезокортикальной систем, что многими рассматривается как один из главных механизмов поражения мозга. В противоположность этому при т.н. большой депрессии приходится применять средства, повышающие концентрацию катехоламинов в синапсах центральной нервной системы. Антидепрессанты помогают многим больным, но, к сожалению, не способны сделать счастливыми здоровых людей, просто переживающих несчастливое время своей жизни.
6.6.3. Серотонин
Этот низкомолекулярный нейромедиатор образуется из аминокислоты триптофана с помощью двух, участвующих в синтезе ферментов. Значительные скопления серотонинэргических нейронов находятся в ядрах шва – тонкой полосе вдоль средней линии каудальной ретикулярной формации. Функция этих нейронов связана с регуляцией уровня внимания и регуляцией цикла сна и бодрствования. Серотонинэргические нейроны взаимодействуют с холинэргическими структурами покрышки моста и норадренэргическими нейронами голубого пятна. Одним из блокаторов серотонинэргических рецепторов является ЛСД, следствием приёма этого психотропного вещества становится беспрепятственный пропуск в сознание таких сенсорных сигналов, которые в норме задерживаются.
6.6.4. Гистамин
Это вещество из группы биогенных аминов синтезируется из аминокислоты гистидина и в самых больших количествах содержится в тучных клетках и базофильных гранулоцитах крови: там гистамин участвует в регуляции различных процессов, в том числе в формировании аллергических реакций немедленного типа. У беспозвоночных это достаточно распространённый медиатор, у человека он используется как нейротрансмиттер в гипоталамусе, где участвует в регуляции эндокринных функций.
6.6.5. Глутамат
Наиболее распространённый возбуждающий нейротрансмиттер головного мозга. Он выделяется аксонами большинства чувствительных нейронов, пирамидными клетками зрительной коры, нейронами ассоциативной коры, образующими проекции на полосатое тело.
Рецепторы для этого медиатора подразделяются на ионотропные и метаботропные. Ионотропные рецепторы глутамата разделяются на два типа, в зависимости от своих агонистов и антагонистов: НМДА (Н-метил-Д-аспартат) и не-НМДА. НМДА рецепторы связаны с катионными каналами, через которые возможен ток ионов натрия, калия и кальция, а каналы не-НМДА рецепторов не пропускают ионы кальция. Входящий через каналы НМДА рецепторов кальций активирует каскад реакций кальций-зависимых вторичных посредников. Считается, что этот механизм играет очень важную роль для формирования следов памяти. Связанные с рецепторами НМДА каналы открываются медленно и только при наличии глицина: они блокируются ионами магния и наркотическим галлюциногеном фенциклидином (который в англоязычной литературе называют "angel dust" – пыльный ангел).
С активацией НМДА рецепторов в гиппокампе связано возникновение очень интересного феномена – долговременной потенциации, особой формы активности нейронов, необходимой для формирования долговременной памяти (См. главу 17). Интересно отметить и тот факт, что чрезмерно высокая концентрация глутамата токсична для нейронов – с этим обстоятельством приходится считаться при некоторых поражениях мозга (кровоизлияния, эпилептические приступы, дегенеративные заболевания, например, хорея Гентингтона).
6.6.6. ГАМК и глицин
Два аминокислотных нейротранмиттера являются важнейшими тормозными медиаторами. Глицин тормозит деятельность интернейронов и мотонейронов спинного мозга. Высокая концентрация ГАМК обнаружена в сером веществе коры мозга, особенно в лобных долях, в подкорковых ядрах (хвостатое ядро и бледный шар), в таламусе, гиппокампе, гипоталамусе, ретикулярной формации. В качестве тормозного медиатора ГАМК используют некоторые нейроны спинного мозга, обонятельного тракта, сетчатки глаза, мозжечка.
Ряд производных от ГАМК соединений (пирацетам, аминолон, оксибутират натрия или ГОМК – гамма-оксимасляная кислота) стимулируют созревание структур мозга и образование стойких связей между популяциями нейронов. Это способствует формированию памяти, что послужило поводом к использованию названных соединений в клинической практике для ускорения восстановительных процессов после различных поражений мозга.
Предполагают, что психотропная активность ГАМК определяется её избирательным влиянием на интегративные функции мозга, которое состоит в оптимизации баланса активности взаимодействующих структур мозга. Так, например, при состояниях страха, фобиях больным помогают специальные антистраховые препараты – бензодиазепины, действие которых состоит в повышении чувствительности ГАМК-эргических рецепторов.
6.6.7. Нейропептиды
В настоящее время около 50 пептидов рассматриваются в качестве возможных нейротрансмиттеров, некоторые из них были известны прежде как нейрогормоны, выделяющиеся нейронами, но действующие вне мозга: вазопрессин, окситоцин. Другие нейропептиды были изучены впервые в качестве местных гормонов пищеварительного тракта, например, гастрин, холецистокинин и т.д., а также гормонов, образующихся в других тканях: ангиотензин, брадикинин и т.д.
Их существование в прежнем качестве по-прежнему не подвергается сомнению, но когда удаётся установить, что тот или иной пептид выделяется нервным окончанием и действует на соседний нейрон, его по справедливости относят и к нейротрансмиттерам. В мозгу значительное количество нейропептидов используется в гипоталамо-гипофизарной системе, хотя не менее хорошо известна, например, функция пептидов в передаче болевой чувствительности в задних рогах спинного мозга.
Все пептиды происходят из больших молекул-предшественниц, которые синтезируются в клеточном теле, изменяются в цитоплазматическом ретикулуме, преобразуются в аппарате Гольджи и доставляются в нервное окончание быстрым аксонным транспортом в секреторных пузырьках. Нейропептиды могут действовать как возбуждающие и как тормозные медиаторы. Часто они ведут себя как нейромодуляторы, т.е. не сами передают сигнал, а в зависимости от необходимости увеличивают или уменьшают чувствительность отдельных нейронов или их популяций к действию возбуждающих или тормозных нейротрансмиттеров.
По одинаковым участкам аминокислотной цепи можно обнаружить сходство между отдельными нейропептидами. Так, например, все эндогенные опиатные пептиды на одном конце цепи имеют одинаковую последовательность аминокислот: тирозин-глицин-глицин-фенилаланин. Именно этот участок является активным центром молекулы пептида. Нередко обнаружение подобного сходства между отдельными пептидами указывает на их генетическое родство. В соответствии с таким родством выделено несколько главных семейств нейроактивных пептидов:
1.Опиатные пептиды: лейцин-энкефалин, метионин-энкефалин, альфа-эндорфин, гамма-эндорфин, бета-эндорфин, дайнорфин, альфа-неоэндорфин.
2. Пептиды нейрогипофиза: вазопрессин, окситоцин, нейрофизин.
3. Тахикинины: вещество Р, бомбезин, физалемин, кассинин, уперолеин, эледоизин, вещество К.
4. Секретины: секретин, глюкагон, ВИП (вазоактивный интестинальный пептид), рилизинг-фактор соматотропина.
5. Инсулины: инсулин, инсулиноподобные ростковые факторы I и II.
6. Соматостатины: соматостатин, полипептид поджелудочной железы.
7. Гастрины: гастрин, холецистокинин.
Некоторые нейроны могут одновременно выделять пептидный и низкомолекулярный медиаторы, например, ацетилхолин и ВИП, причём оба действуют на одну и ту же мишень как синергисты. Но может быть и по-другому, как, например, в гипоталамусе, где выделяемые одним нейроном глутамат и дайнорфин действуют на одну постсинаптическую мишень, но глутамат возбуждает, а опиоидный пептид – ингибирует. Скорее всего пептиды в таких случаях действуют как нейромодуляторы. Иногда вместе с нейротрансмиттером выделяется ещё и АТФ, которая в некоторых синапсах тоже рассматривается в качестве медиатора, если, конечно, удаётся доказать наличие рецепторов для неё на постсинаптической мембране.
6.7. Опиатные пептиды
Семейство опиатных пептидов насчитывает свыше десятка веществ, молекулы которых включают от 5 до 31 аминокислот. У этих веществ есть общие биохимические особенности, хотя пути их синтеза могут отличаться. Например, синтез бета-эндорфина связан с образованием адренокортикотропного гормона (АКТГ) из общей крупной молекулы белка-предшественника – проопиомеланокортина, тогда как энкефалины образуются из другого предшественника, а дайнорфин – из третьего.
Поиск опиатных пептидов начался после обнаружения в мозгу опиатных рецепторов, связывающих алкалоиды опиума (морфин, героин и т.п.). Поскольку трудно представить появление таких рецепторов для связывания лишь посторонних веществ, их начали искать внутри организма. В 1975 году в журнале "Nature" появилось сообщение об открытии двух малых пептидов, которые состояли из пяти аминокислот, связывались с опиатными рецепторами и действовали сильнее, чем морфин. Авторы этого сообщения (Hughes J., Smith T.W., Kosterlitz H.W. и др.) назвали обнаруженные вещества энкефалинами (т.е. в голове). Через короткое время из гипоталамо-гипофизарного экстракта выделили ещё три пептида, которые назвали эндорфинами, т.е. эндогенными морфинами, затем был обнаружен дайнорфин и т.д.
Все опиатные пептиды иногда называют эндорфинами. Они связываются с опиатными рецепторами лучше, чем морфин, и действуют в 20-700 раз сильнее его. Описано пять функциональных типов опиатных рецепторов, вместе с самими пептидами они образуют весьма сложную систему. Присоединение пептида к рецептору приводит к образованию вторичных посредников, относящихся к системе цАМФ.
Самое высокое содержание опиоидных пептидов обнаружено в гипофизе, однако синтезируются они преимущественно в гипоталамусе. Значительное количество бета-эндорфина встречается в лимбической системе мозга, обнаруживается он и в крови. Концентрация энкефалинов особенно высока в задних рогах спинного мозга, где происходит передача сигналов от болевых окончаний: там энкефалины уменьшают выделение вещества Р – медиатора передачи информации о боли.
У экспериментальных животных можно вызвать обезболивание путём микроинъекции бета-эндорфина в желудочек мозга. Другой способ обезболивания состоит в электростимуляции нейронов, расположенных вокруг желудочка: при этом повышается концентрация эндорфинов и энкефалинов в ликворе. К такому же результату, т.е. к обезболиванию, приводило и введение b-эндорфинов, и стимуляция перивентрикулярной (околожелудочковой) области у онкологических больных. Интересно, что уровень опиатных пептидов повышается в ликворе и при обезболивании с помощью акупунктуры, и при эффекте плацебо (когда больной принимает лекарство, не зная, что в нём нет активного действующего начала).
Помимо аналгезирующего, т.е. обезболивающего действия опиоидные пептиды влияют на образование долговременной памяти, процесс научения, регулируют аппетит, половые функции и сексуальное поведение, они являются важным звеном стресс-реакции и процесса адаптации, они обеспечивают связь между нервной, эндокринной и иммунной системами (опиатные рецепторы обнаружены у лимфоцитов и моноцитов крови).
Резюме
В центральной нервной системе для передачи информации между клетками используются как низкомолекулярные, так и пептидные нейротрансмиттеры. Разные популяции нейронов используют различные медиаторы, этот выбор определён генетически и обеспечен определённым набором ферментов, необходимых для синтеза. Для одного и того же медиатора у разных клеток есть различные типы постсинаптических рецепторов, с ионотропным или метаботропным управлением. Метаботропное управление осуществляется при участии преобразующих белков и различных систем вторичных посредников. Некоторые нейроны выделяют одновременно с низкомолекулярным ещё и пептидный медиатор. Отличающиеся выделяемым медиатором нейроны в определённом порядке сосредоточены в разных структурах мозга.
Вопросы для самоконтроля
81. Что из перечисленного ниже не является критерием для отнесения вещества к нейромедиаторам?
А. Синтезируется в нейроне; Б. Накапливается в пресинаптическом окончании; В. Оказывает специфическое действие на эффектор; Г. Выделяется в кровь; Д. При искусственном введении наблюдается эффект, аналогичный тому, что бывает при естественном выделении.
82. Что позволяет считать вещество агонистом нейромедиатора?
А. Препятствует освобождению медиатора из пресинаптического окончания; Б. Действует подобно медиатору; В. Действует иначе, чем медиатор; Г. Блокирует постсинаптические рецепторы; Д. Не связывается с постсинаптическими рецепторами.
83. Что из перечисленного ниже характерно для пептидных нейротрансмиттеров?
А. Образуются при ферментативном окислении аминокислот; Б. Образуются в результате декарбоксилирования аминокислот; В. Могут синтезироваться в пресинаптическом окончании; Г. Доставляются в пресинаптическое окончание медленным аксоплазматическим транспортом; Д. Образуются в клеточном теле нейрона.
84. Что вызывает ток ионов кальция в пресинаптическое окончание во время передачи информации через синапс?
А. Потенциал действия; Б. Потенциал покоя; В. Экзоцитоз; Г. Связь синаптических пузырьков с цитоскелетом; Д. Возникновение постсинаптического потенциала.
85. Что преобразует возбуждение пресинаптического окончания в неэлектрическую активность (выделение нейромедиатора)?
А. Экзоцитоз; Б. Входящий ток ионов кальция; В. Вход ионов натрия при возбуждении окончания; Г. Выход ионов калия во время реполяризации; Д. Повышение активности ферментов, необходимых для синтеза медиатора.
86. Чем обусловлена посттетаническая потенциация?
А. Суммацией квантов медиатора; Б. Повышением скорости диффузии медиатора; В. Повышением концентрации ионов кальция в пресинаптическом окончании; Г. Повышением активности ферментов для синтеза медиатора; Д. Высокой плотностью каналов для кальция в области активных зон.
87. Какое из перечисленных ниже событий приводит к активации G-белков?
А. Превращение ГДФ в ГТФ; Б. Превращение АТФ в цАМФ; В. Активация аденилатциклазы; Г. Активация протеинкиназы; Д. Образование постсинаптического потенциала.
88. Какое из указанных событий должно произойти раньше других при метаботропном управлении?
А. Образование цАМФ; Б. Активация протеинкиназы; В. Активация аденилатциклазы; Г. Активация G-белка; Д. Открытие ионного канала.
89. Какую функцию выполняют ауторецепторы пресинаптической мембраны?
А. Осуществление обратного транспорта нейротрансмиттеров; Б. Регуляция количества медиатора в синаптической щели; В. Включение механизмов расщепления медиатора; Г. Ионотропное управление каналами пресинаптической мембраны; Д. Связывание медиатора, выделяющегося из постсинаптического нейрона.
90. Какой из указанных механизмов не используется для удаления медиаторов из синаптической щели?
А. Ферментативное расщепление; Б. Захват молекул медиатора клетками глии; В. Захват молекул медиатора постсинаптическим нейроном; Г. Транспорт молекул медиатора в окончание пресинаптического нейрона; Д. диффузия.
91. При прогрессирующем слабоумии (болезни Альцгеймера) нарушен синтез одного из нейромедиаторов. Это:
А. Ацетилхолин; Б. Глутамат; В. Дофамин; Г. Норадреналин; Д. ГАМК.
92. Какой медиатор выделяют нейроны голубого пятна?
А. Дофамин; Б. Глицин; В. Глутамат; Г. Норадреналин; Д. Адреналин.
93. Какой медиатор синтезируется в нейронах чёрной субстанции среднего мозга?
А. Дофамин; Б. Норадреналин; В. Ацетилхолин; Г. b-Эндорфин; Д. Глутамат.
94. В какой из перечисленных ниже структур мозга обнаружена самая высокая концентрация дофамина?
А. Ретикулярная формация; Б. Затылочная кора; В. Лобная кора; Г. Мозжечок; Д. Таламус.
95. Какой медиатор выделяют нейроны ядер шва?
А. Дофамин; Б. Норадреналин; В. Серотонин; Г. Гистамин; Д. Глицин.
96. Какой медиатор действует на НМДА-рецепторы?
А. Ацетилхолин; Б. Глутамат; В. Глицин; Г. Энкефалин; Д. Адреналин.
97. Для ускорения восстановительных процессов и улучшения памяти после повреждений мозга используют производные одного из нейротрансмиттеров. Укажите его.
А. ГАМК; Б. Глицин; В. Ацетилхолин; Г. Глутамат; Д. Дофамин.
98. Какое из перечисленных ниже веществ не является пептидным нейротрансмиттером?
А. Эндорфин; Б. Глицин; В. Вещество Р; Г. Соматостатин; Д. Энкефалин.
99. Какой медиатор синтезируется некоторыми нейронами головного мозга и оказывает влияние на передачу информации о болевых стимулах в спинном мозгу?
А. Эндорфин; Б. Энкефалин; В. Вещество Р. Г. Окситоцин; Д. Вазопрессин.
100. В какой области мозга в качестве медиаторов особенно часто используются пептидные нейротрансмиттеры?
А. Мозжечок; Б. Ретикулярная формация; В. Гипоталамус и гипофиз; Г. Лобная кора; Д. Подкорковые ядра.
| Назад | Оглавление | Далее |